
【题目】如图为一个电解装置,该装置中X、Y分别为石墨电极,现分别在U型管中加入下列溶液进行电解,请回答有关问题:
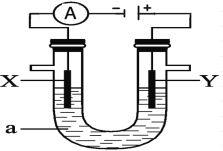
(1)若U型管中的液体a为饱和食盐水:在电极Y上产生的气体是_________ (填分子式),检验有该气体生成的简单方法是________________________;若该饱和食盐水中还含有少量的镁离子,则有可能在______极(选填“X”或“Y”)附近会首先生成白色不溶物;当电解产生0.2mol氢氧化钠时,能收集到标准状况下的氢气 ______升;工厂应用电解生成的氯气和氢气可以化合生成氯化氢,某工厂每天电解400t食盐,若生成的氯气80%用于生产盐酸,每天最多可生产31%的盐酸__________ t。(保留至整数)
(2)若U型管中的液体a为饱和氯化铜溶液:电极质量增加的是_______选填“X”或“Y”)极,该电极上发生______反应(选填“氧化”或“还原”);若要得到0.32克铜,理论上在电解过程中应转移_________mol电子;氯化铜溶液显酸性,原因是(用离子方程式表示)_______________________________;电解一段时间后,请你推测:整个溶液的酸性将如何变化(增强、减弱、不变,同时请写出理由:_______
【答案】Cl2 湿润的淀粉碘化钾试纸变蓝 X 22.4L 644 X 还原 0.01mol Cu2++2H2O![]() Cu(OH)2+2H+ 铜离子浓度减小,水解程度减弱,酸性减弱
Cu(OH)2+2H+ 铜离子浓度减小,水解程度减弱,酸性减弱
【解析】
(1)若U型管中的液体a为饱和食盐水,则该装置是电解饱和食盐水的装置,根据相关知识回答问题;
(2) 若U型管中的液体a为饱和氯化铜溶液,则该装置是电解饱和氯化铜的装置,根据相关知识回答问题。
(1)若U型管中的液体a为饱和食盐水,Y与电源正极相连为阳极,阳极反应为2Cl--2e-=Cl2↑,产生的气体是Cl2;检验氯气的方法是:湿润的淀粉碘化钾试纸变蓝;X为阴极,阴极反应为2H++2e-=H2↑,阴极附近会产生氢氧根,生成白色的氢氧化镁沉淀,故在X极附近会首先生成白色不溶物;当电解产生0.2mol氢氧化钠时,同时消耗0.2mol H+,生成0.1mol氢气,标况下的体积为0.1mol![]() 22.4L/mol=2.24L;电解氯化钠溶液的原理方程式为:2NaCl+2H2O
22.4L/mol=2.24L;电解氯化钠溶液的原理方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,电解400 t食盐,则生成氯气物质的量为
Cl2↑+H2↑+2NaOH,电解400 t食盐,则生成氯气物质的量为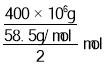 =3.42
=3.42![]() mol,氯气80%用于生产盐酸,可得到质量分数为31%的盐酸为
mol,氯气80%用于生产盐酸,可得到质量分数为31%的盐酸为![]() =644t;
=644t;
(2)电解氯化铜溶液时,X作为阴极,发生反应:Cu + 2e = Cu,质量增加;该电极得电子,发生还原反应;生成1mol铜转移2mol电子,若要得到0.32克铜,需要转移![]() =0.01mol;氯化铜溶液显酸性的原因是铜离子发生了水解,离子方程式为:Cu2++2H2O
=0.01mol;氯化铜溶液显酸性的原因是铜离子发生了水解,离子方程式为:Cu2++2H2O![]() Cu(OH)2+2H+;电解氯化铜溶液的总方程式为:CuCl2
Cu(OH)2+2H+;电解氯化铜溶液的总方程式为:CuCl2 ![]() Cu + Cl2
Cu + Cl2![]() ,电解一段时间后,铜离子浓度减小,水解程度减弱,酸性减弱。
,电解一段时间后,铜离子浓度减小,水解程度减弱,酸性减弱。


科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据如图所示,回答下列问题:

(1)Y是形成酸雨的主要物质之一,它溶于水反应的化学方程式为_____;另一类硝酸型酸雨主要由人类活动产生的NOx造成的,写出NO2与水反应的化学方程式为______;酸雨的pH______(填范围)。
(2)Y能使品红溶液褪色,它与一种黄绿色气体等体积通入水中得到的溶液却几乎没有漂白性,反应的离子方程式为_______;Y也能使酸性高锰酸钾溶液褪色,写出该反应的离子方程式______,并用单线桥法标明电子转移的方向和数目,体现了Y的_____性。
(3)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为_____。
(4)现用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL,回答下列问题:
①所需浓硫酸的体积为______mL。
②将浓硫酸沿烧杯内壁缓缓注入盛水的烧杯中,不断搅拌的目的是_____,若搅拌过程中有液体溅出,会导致最终所配溶液浓度_____(填“偏大”、“偏小”或“无影响”,下同)。
③在转入容量瓶前,烧杯中的液体应先_____,否则会使浓度_____。
(5)已知S的氧化性较弱,则硫粉与铜加热反应的化学方程式为_____。
(6)欲制备Na2S2O3(硫代硫酸钠),从氧化还原反应角度分析,合理的是_____(填序号)。
A.Na2S+S B.Na2SO3+S C.Na2SO3+Na2SO4 D.SO2+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用毒重石制备BaCl2·2H2O的流程如图:
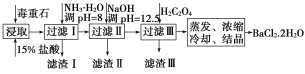
(1)毒重石用盐酸浸取前需充分研磨,目的是__。
(2)加入NH3·H2O调pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。加入H2C2O4时应避免过量,原因是__。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O
Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的__(填“上方”或“下方”)。BaCl2溶液的浓度为__mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将__(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(![]() ,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩尔质量)
(忽略端基的摩尔质量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其示意图如右图。下列说法不正确的是
已知:①Zn(OH)2+2OH == Zn(OH)42 。 ②KOH凝胶中允许离子存在、生成或迁移。
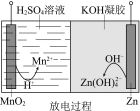
A.放电过程中,H+由正极向负极迁移
B.放电过程中,正极的电极反应:MnO2+4H++2e== Mn2++2H2O
C.充电过程中,阴极的电极反应:Zn(OH)42+2e == Zn+4OH
D.充电过程中,凝胶中的KOH可再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氰根(CN)的废水必须经处理后排放。某电镀废水pH≈12,氰化物以CN、Cu(CN)32等形式存在(均以CN计),处理流程如下:
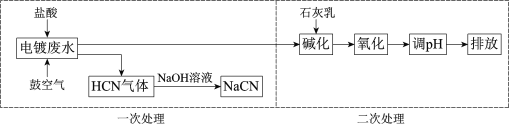
(1)HCN是一元弱酸,用离子方程式表示NaCN水溶液显碱性的原因:______。
(2)二次处理阶段,使用不同方法氧化。
①过硫酸钾(K2S2O8)氧化法:K2S2O8溶液将CN(N为-3价)氧化成毒性弱的CNO(N为-3价)。
Ⅰ.碱性溶液中S2O82在一定条件下氧化CN生成CNO和SO42的离子方程式是______。
Ⅱ.不同浓度的K2S2O8溶液对CN的去除率如图1。工业上选用浓度为1 mmol·L1
K2S2O8溶液,不用0.75 mmol·L1和2 mmol·L1的原因是______。
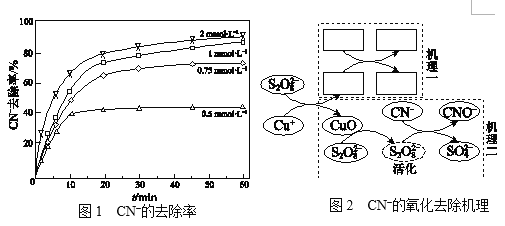
Ⅲ.研究CN的氧化去除机理。(文献中为碱性条件下的结论)
文献:a.没有Cu+,S2O82对CN没有去除效果。
b.S2O82和Cu+反应生成硫酸根自由基(SO4·)和CuO。
c.SO4·可能转变为羟基自由基(·OH)。
d.SO4· 、·OH均可将CN氧化为CNO。叔丁醇只可以使·OH失
去活性,乙醇可以使SO4· 、·OH均失去活性。
实验:相同条件下,向含Cu(CN)32的碱性废水中加入叔丁醇,CN的去除率没有影响;加入乙醇,CN的去除率降低50%。两种不同的CN的氧化去除机理如图2,结合文献和实验回答下列问题:
ⅰ.补全“机理一”_______________。
ⅱ.从“机理二”可看出CuO参与了去除CN,列举其证据:______。
②电解法:碱性环境中,在阳极发生两步反应,CN放电生成CNO,CNO再放电生成CO2和N2,第二步的阳极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体
稀硝酸的溶液中,恰好完全反应,放出无色气体![]() 标准状况下
标准状况下![]() 。将反应后的溶液分成2等份,向一份溶液中滴加
。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体![]() ,减轻了
,减轻了![]() ,再加入到过量的
,再加入到过量的![]() 溶液中,剩余不溶物
溶液中,剩余不溶物![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
已知:![]() 遇到
遇到![]() 会出现蓝色沉淀;
会出现蓝色沉淀; ![]()
A.![]()
B.原合金中铜的质量为![]()
C.若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() 标准状况下
标准状况下![]()
D.d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
电离平衡常数(25 ℃) | Ka=1.77 ×10-4 | Ka=4.0 ×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)在温度相同时,各弱酸的Ka值与酸性的相对强弱的关系为________________。
(2)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1 NaHCO3溶液的pH由大到小的关系为______________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2=2HClO+CO![]()
b.2HCOOH+CO![]() =2HCOO-+H2O+CO2↑
=2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-=2HCOOH+SO![]()
d.Cl2+H2O+2CO![]() =2HCO
=2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(5)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com