
【题目】下列说法正确的是( )
A.mA(g)+nB(g) ![]() pC(g),平衡时A的浓度等于0.5mol·L-1 ,其它条件不变,将容器体积扩大一倍,达到新的平衡时A的浓度变为0.3mol·L-1 ,则化学计量数m+n<p
pC(g),平衡时A的浓度等于0.5mol·L-1 ,其它条件不变,将容器体积扩大一倍,达到新的平衡时A的浓度变为0.3mol·L-1 ,则化学计量数m+n<p
B.将一定量纯净的氨基甲酸铵置于密闭真空容器中,在恒定温度下使其分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判定依据
2NH3(g)+CO2(g),则CO2的体积分数不变能作为平衡判定依据
C.对于反应A(g)+B(g) ![]() 2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时给体系加压,则A的体积分数不变
2C(g),起始充入等物质的量的A和B,达到平衡时A的体积分数为n%,此时给体系加压,则A的体积分数不变
D.2NO(g)+2CO(g) ![]() N2+2CO2在常温下能够进行,则反应的△H <0
N2+2CO2在常温下能够进行,则反应的△H <0
【答案】C
【解析】
A、平衡时A的浓度等于0.5 mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,可知压强减小,平衡逆向移动;
B、生成物中氨气、二氧化碳的体积比始终为2:1;
C、该反应为气体体积不变的反应;
D、由化学计量数可知△S<0,△H-T△S<0的反应可自发进行。
A、平衡时A的浓度等于0.5mol/L,将容器体积扩大一倍,达到新的平衡后A的浓度变为0.3mol/L,可知压强减小,平衡逆向移动,则化学计量数m+n>p,故A错误;
B、生成物中氨气、二氧化碳的体积比始终为2:1,CO2的体积分数始终不变,不能作为平衡判断的依据,故B错误;
C、该反应为气体体积不变的反应,平衡时A的体积分数为n%,此时若给体系加压,平衡不移动,则A的体积分数不变,故C正确;
D、由化学计量数可知△S<0,△HT△S<0的反应可自发进行,在常温下能自发进行,则该反应的△H<0,故D错误。


科目:高中化学 来源: 题型:
【题目】浓度都是1mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后c(X(2)为0.4mol/L,c(Y(2)为0.8mol/L,生成的c(Z)为0.4mol/L,则该反应是
A.3X2+Y2![]() 2X3YB.X2+3Y2
2X3YB.X2+3Y2![]() 2XY3C.X2+2Y2
2XY3C.X2+2Y2![]() 2XY2D.2X2+Y2
2XY2D.2X2+Y2![]() 2X2Y
2X2Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PET(![]() ,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
,M链节= 192 g·mol1)可用来生产合成纤维或塑料。测某PET样品的端基中羧基的物质的量,计算其平均聚合度:以酚酞作指示剂,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至终点(现象与水溶液相同),消耗NaOH醇溶液v mL。下列说法不正确的是
A.PET塑料是一种可降解高分子材料
B.滴定终点时,溶液变为浅红色
C.合成PET的一种单体是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩尔质量)
(忽略端基的摩尔质量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,两个恒容密闭容器中仅发生反应2NO2(g)![]() 2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
2NO(g) +O2(g) ΔH > 0。实验测得:υ正(NO2)=k正c2(NO2),υ逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器 编号 | 起始浓度(mol·L1) | 平衡浓度(mol·L1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.6 | 0.1 | 0 | |
下列说法不正确的是
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L1
C.该反应的化学平衡常数可表示为K=![]()
D.升高温度,该反应的化学平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氰根(CN)的废水必须经处理后排放。某电镀废水pH≈12,氰化物以CN、Cu(CN)32等形式存在(均以CN计),处理流程如下:
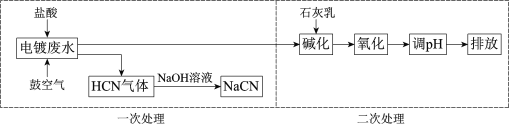
(1)HCN是一元弱酸,用离子方程式表示NaCN水溶液显碱性的原因:______。
(2)二次处理阶段,使用不同方法氧化。
①过硫酸钾(K2S2O8)氧化法:K2S2O8溶液将CN(N为-3价)氧化成毒性弱的CNO(N为-3价)。
Ⅰ.碱性溶液中S2O82在一定条件下氧化CN生成CNO和SO42的离子方程式是______。
Ⅱ.不同浓度的K2S2O8溶液对CN的去除率如图1。工业上选用浓度为1 mmol·L1
K2S2O8溶液,不用0.75 mmol·L1和2 mmol·L1的原因是______。
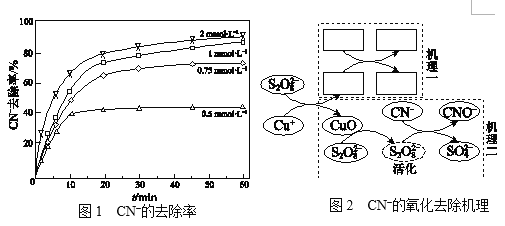
Ⅲ.研究CN的氧化去除机理。(文献中为碱性条件下的结论)
文献:a.没有Cu+,S2O82对CN没有去除效果。
b.S2O82和Cu+反应生成硫酸根自由基(SO4·)和CuO。
c.SO4·可能转变为羟基自由基(·OH)。
d.SO4· 、·OH均可将CN氧化为CNO。叔丁醇只可以使·OH失
去活性,乙醇可以使SO4· 、·OH均失去活性。
实验:相同条件下,向含Cu(CN)32的碱性废水中加入叔丁醇,CN的去除率没有影响;加入乙醇,CN的去除率降低50%。两种不同的CN的氧化去除机理如图2,结合文献和实验回答下列问题:
ⅰ.补全“机理一”_______________。
ⅱ.从“机理二”可看出CuO参与了去除CN,列举其证据:______。
②电解法:碱性环境中,在阳极发生两步反应,CN放电生成CNO,CNO再放电生成CO2和N2,第二步的阳极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d为离子化合物,其结构中还含非极性共价键,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径:W<X<Y<Z
B. 阴离子的还原性:Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a一定由W、X两种元素组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体
稀硝酸的溶液中,恰好完全反应,放出无色气体![]() 标准状况下
标准状况下![]() 。将反应后的溶液分成2等份,向一份溶液中滴加
。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体![]() ,减轻了
,减轻了![]() ,再加入到过量的
,再加入到过量的![]() 溶液中,剩余不溶物
溶液中,剩余不溶物![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()
已知:![]() 遇到
遇到![]() 会出现蓝色沉淀;
会出现蓝色沉淀; ![]()
A.![]()
B.原合金中铜的质量为![]()
C.若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() 标准状况下
标准状况下![]()
D.d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一。
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
②CO(g)+![]() O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
(1)则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是_______,该反应的化学平衡常数K随温度的升高将_______(填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向____________(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计下列实验(图中用于加热的仪器没有画出)制取Mg3N2,观察到装置A的黑色的固体变成红色,装置D的镁条变成白色,回答下列问题:
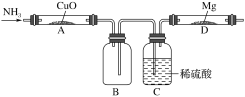
(1)装置A中生成的物质是纯净物,则可能是_________,证明的方法是_____________。
(2)设计C装置的作用是________________,缺陷是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com