
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g) ![]() 2ClNO(g)。已知几种化学的键能数据如下表所示:
2ClNO(g)。已知几种化学的键能数据如下表所示:

当Cl2与NO反应生成ClNO的过程中转移了4mol电子,理论上放出的热量为____kJ.
(2)在一个恒容密闭容器中充入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
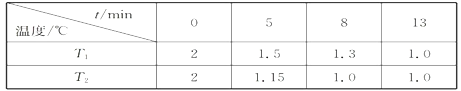
①T1________T2(填“>“”<”或”=”)。
②温度为T2℃时,在相同容器中,充入4molNO(g)和2mo1Cl2(g),则NO的平衡转化率___________50%(填“大于”、“等于”或“小于”)
③温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示
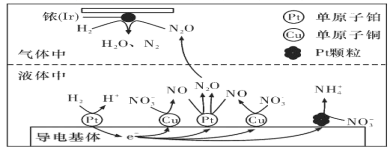
①Ir表面发生反应的方程式为_________________________________________________。
②若导电基体上的Pt颗粒增多,造成的后果是___________________________________。
II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示
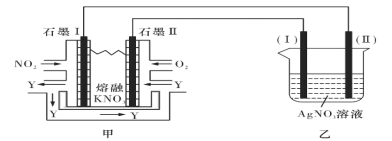
请回答下列问题:
(4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨II负极发生的电极反应式为____________________________________________。
②若用10A的电流电解60min,已知该电解池的电解效率为80.4%,则乙中阴极得到____g质量的Ag。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C/mol)
【答案】222.0 < 大于 ![]() H2+N2O = N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体 O2+4e-+2N2O5=4NO3- 32.4
H2+N2O = N2+H2O 若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体 O2+4e-+2N2O5=4NO3- 32.4
【解析】
(1)2NO(g)+Cl2(g)2ClNO(g),反应的焓变△H=反应物总键能-生成物总键能,据此计算;
(2)①温度越高,反应速率越大,达到平衡状态所需要的时间短;
②在相同容器中,充入4mol NO和2mol Cl2,相当于增加一倍反应物浓度,容器中压强增大,反应向正反应方向进行;据此分析;
③分压=总压×物质的量分数,则Kp=![]() ;
;
(3)①由原理的示意图可知,Ir的表面氢气和N2O发生反应生成N2和H2O;
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根。
(4)①甲池工作时,NO2转变成N2O5,说明氮元素的化合价升高,石墨Ⅰ为负极,电极反应式为NO2+NO3--e-=N2O5,石墨Ⅱ为正极O2+2N2O5+4e-═4NO3-;
②先计算电子的物质的量,求出理论可得到Ag,再根据电解效率求出实际所得。
(1)2NO(g)+Cl2(g)2ClNO(g),1mol Cl2参与反应发生焓变△H=243KJ/mol+2×630KJ/mol-2×(200KJ/mol+607KJ/mol)=-111kJ/mol,此时转移2mol电子,则有4mol电子转移时,热量变化为222.0kJ,
故答案为:222.0;
(2)①温度越高,反应速率越大,单位时间内消耗NO的量越多,所以T1<T2,
故答案为:<;
②在一个恒容密闭容器中充入2 mol NO(g)和1molCl2(g)发生(2)中反应,达到平衡状态,NO转化率=(2mol-1mol)/2mol×100%=50%,在相同容器中,充入4mol NO和2mol Cl2,相当于增加一倍反应物浓度,容器中压强增大,反应向正反应方向进行,
故答案为:大于;
③起始物质的量为3mol,压强为p0,反应后各物质变化为:n(NO)=1mol,n(Cl2)=0.5,n(ClNO)=1mol,反应后总物质的量为2.5mol,压强为2.5/3P0=5/6P0,则 ,故答案为:
,故答案为:![]() ;
;
(3)①由原理的示意图可知,Ir的表面发生反应:H2+N2O = N2+H2O,
故答案为:H2+N2O = N2+H2O
②由原理的示意图可知,若导电基体上的Pt颗粒增多,则NO3-会更多的转化成铵根,不利于降低溶液中的含氮量,
故答案为:若Pt颗粒增多,NO3-更多转化为NH4+存在溶液中,不利于降低溶液中含氮量,产生有污染的气体;
(4)①甲池工作时,NO2转变成N2O5,说明氮元素的化合价升高,石墨Ⅰ为负极,电极反应式为NO2+NO3--e-=N2O5,石墨Ⅱ为正极,电极反应:O2+2N2O5+4e-═4NO3-,
故答案为:O2+2N2O5+4e-═4NO3-;
②用10A的电流电解60min,则电子的物质的量为(10×60×60)/96500mol=0.373mol,理论可得到0.373molAg,电池效率为80.4%,所以实际得到的Ag为0.373mol×80.4%=32.4g,
故答案为:32.4。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用![]() 标注。下列说法正确的是( )
标注。下列说法正确的是( )
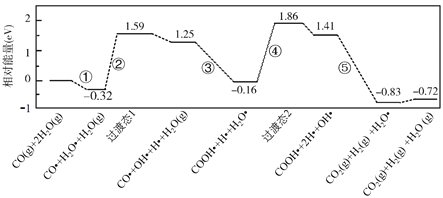
A.水煤气变换反应的ΔH>0
B.步骤③的化学方程式为:CO●+OH●+H2O(g)=COOH●+H2O●
C.步骤⑤只有非极性键H-H键形成
D.该历程中最大能垒(活化能)E正=1.70eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A、B、C、D、E物质相互转化关系如图所示(反应条件和部分产物略),其中A、B、C为单质。
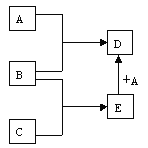
(1)若A为金属,B、C常温下均为气体,D为黑色晶体,E为一种生活中必不可少的物质,则这五种物质的化学式为:A为__,B为__,C为__,D为__,E为__。
(2)A和E在一定条件下反应生成D的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,VIA元素单质与H2反应生成气态H2X的热化学方程式如下:
![]() O2(g) +H2(g) =H2O(g)
O2(g) +H2(g) =H2O(g) ![]() H=-242kJ·mol-1
H=-242kJ·mol-1
S(g)+ H2(g) =H2S(g) ![]() H=-20kJ·mol-1
H=-20kJ·mol-1
Se(g)+H2(g)![]() H2Se(g)
H2Se(g) ![]() H=+81kJ·mol-1
H=+81kJ·mol-1
下列说法正确的是
A. 稳定性:H2O< H2S< H2Se
B. 降温有利于Se与H2反应生成H2Se
C. O2(g)+2H2S(g)=2H2O(g)+2S(g) ![]() H=-444 kJ·mol-1
H=-444 kJ·mol-1
D. 随着核电荷数的增加,VIA族元素单质与H2的化合反应越容易发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是首脍炙人口的江苏民歌。乙酸苯甲酯可以从茉莉花中提取,也可用如图路线合成:
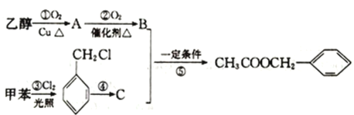
(1)乙酸苯甲酯的分子式为__,C的结构简式为__,B中所含官能团的名称为__,③的反应类型为___。
(2)①的化学方程式为___。
(3)乙酸苯甲酯与NaOH溶液反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在照相底片的定影过程中,未曝光的溴化银(AgBr)常用硫代硫酸钠(Na2S2O3)溶解,反应生成Na3[Ag(S2O3)2];在废定影液中加入Na2S使Na3[Ag(S2O3)2]中的银转化为Ag2S,并使定影液再生。将Ag2S在高温下转化为Ag,就达到了回收银的目的。
(1)铜、银、铬在元素周期表均为过渡金属元素,其中基态铬原子的价电子排布式为______。
(2)Na、O、S简单离子半径由大到小的顺序为___________(用简单离子符号表示离子半径)。
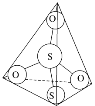
(3)S2O32-离子结构如图1所示,其中心硫原子的杂化轨道类型为________。
(4)Na3[Ag(S2O3)2]中存在的作用力有_____________。
A.离子键 B.共价键 C.范德华力 D.金属键 E.配位键
(5)在空气中灼烧Ag2S生成Ag和SO2,SO2分子空间构型为____________________;与SO3相比,____________的键角更大,原因是________________________________。

(6)如图是金属氢化物储氢材料,其晶胞如图所示,其化学式为____________________,已知该晶体的密度为ρg/cm3,则该晶胞的体积为_________ cm3(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(s)![]() B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
B(g)+C(g)在体积固定的密闭容器中,起始时加入一定量的A,判断反应达到平衡状态的标志是: ①单位时间内生成2molA的同时生成1molB ②v(B):v(C)=1:1 ③密闭容器中混合气体的平均摩尔质量不变 ④混合气体的密度不再改变 ⑤B的体积分数不再改变 ⑥混合气体的压强不再改变的状态
A. ①③④⑤⑥ B. ①③④⑥ C. ①④⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据相应的图象(图象编号与答案一一对应),判断下列相关说法正确的是( )
选项 | A | B | C | D |
图像 |
|
|
|
|
反应 | aX(g)+bY(g)cZ(g) | L(s)+aG(g)bR(g) | aA+bBcC | A+2B2C+3D |
操作或条件 | 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体,D为固体或液体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质结构决定性质,新材料的不断涌现有力地促进了社会进步,因此了解物质结构具有重要意义。试回答下列问题:
(1)基态铁原子中未成对电子数为_________,在水溶液中常以Fe2+、Fe3+的形式存在,其中________更稳定。
(2)OF2中氧元素的化合价为____,中心原子的杂化方式为___,OF2的分子极性比H2O的__________(选填“大”或“小”)。
(3)一种新型铝离子电池中的电解质溶液由某种有机阳离子与AlCl4﹣、Al2Cl7﹣构成,AlCl4﹣的立体构型为_________,Al2Cl7﹣中的原子都是8电子结构,则Al2Cl7﹣的结构式为(配位键用“→”表示)__________。
(4)FeO晶体与NaCl晶体结构相似,要比较FeO与NaCl的晶格能大小,还需要知道的数据是___________;
(5)氮化铝、氮化硼、氮化镓晶体的结构与金刚石相似,它们晶体的熔点由高到低的顺序是___________。
(6)NH3分子中∠HNH键角为106.7,而配离子[Zn(NH3)6]2+中∠HNH键角为109.5, 配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_____。
(7)下图是Fe3O4晶体的晶胞。

①晶胞中亚铁离子处于氧离子围成的______(选填“正方形”、“正四面体”或“正八面体”)空隙。
②晶胞中氧离子的堆积方式的名称为________。
③若晶胞的体对角线长为 a nm,则 Fe3O4 晶体的密度为________g/cm3(阿伏加德罗常数用 NA 表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com