
科目: 来源: 题型:
【题目】近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2 ,下列说法不正确的是

A. 太阳能最终转变为化学能 B. T<1050℃时,CeO2-δ比CeO2稳定
C. CeO2是水分解的催化剂 D. 两步反应均属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.向盛有硫酸铜溶液的试管里加入过量氨水,将得到深蓝色的[Cu(NH3)4]SO4·H2O沉淀
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.杂化轨道只用于形成σ键或用于容纳未参与成键的孤电子对
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键,其立体构形都是正四面体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验操作的说法正确的是![]()
A.蒸馏操作时,应使温度计水银球伸入蒸馏烧瓶液面下
B.铂丝蘸取试样灼烧,火焰呈黄色,则该试样一定是钠盐
C.测定溶液的pH的规范操作是:用干燥洁净的玻璃棒蘸取溶液,点在pH试纸中央,跟标准比色卡比较
D.分液时,分液漏斗下层液体先从下口放出,然后将上层液体放出
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | a | 2.0 | 2.0 | 5.2 |
3 | 3.0 | b | 2.0 | 1.0 | 6.4 |
(1)a=________,b=__________.根据上表中的实验数据,该组实验的结论_____________。
(2)①该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
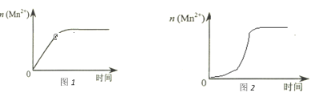
该小组同学提出的假设是___________。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是__________。
③若该小组同学提出的假设成立,时间t__________4.0min(填>、=或<)。
Ⅱ.某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30%H2O2、0.1mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器。参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母abcdef...表示)。
物理量 实验序号 | V/mL[0.1 mol·L-1 Fe2(SO4)3] | ||||
1 | a | ||||
2 | a |
________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从![]() 甲烷
甲烷![]() 甲醛
甲醛![]() 乙酸
乙酸![]() 油脂
油脂![]() 纤维素
纤维素![]() 聚乙烯六种有机物中选择合适的物质,将其标号添在横线上.
聚乙烯六种有机物中选择合适的物质,将其标号添在横线上.
![]() 瓦斯的主要成分是 ______ ;
瓦斯的主要成分是 ______ ;
![]() 可制成食品保鲜膜和保鲜袋的 ______ ;
可制成食品保鲜膜和保鲜袋的 ______ ;
![]() 食醋可做增强食品酸味的调味剂,是因为其中含有 ______ ;
食醋可做增强食品酸味的调味剂,是因为其中含有 ______ ;
![]() 福尔马林溶液可以作为保存动物标本的溶液,是因为其中含有
福尔马林溶液可以作为保存动物标本的溶液,是因为其中含有![]() 的 ______ ;
的 ______ ;
![]() 可用来制造肥皂的原料的是 ______ ;
可用来制造肥皂的原料的是 ______ ;
![]() 纯棉的衣服的化学成分是 ______ .
纯棉的衣服的化学成分是 ______ .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述中正确的是
A.CS2为V形的极性分子
B.ClO3-的空间构型为平面三角形
C.SF6中S原子和氟原子均满足最外层8电子稳定结构
D.SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的_____;
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O![]() N2H5++OH- K1=1×10-a;N2H5++H2O
N2H5++OH- K1=1×10-a;N2H5++H2O![]() N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液中c(OH-)的范围为_____________________(用含a、b式子表示)。
(2)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c(NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
NH3·H2O+H2CO3的平衡常数K=_________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×107mol·L1,K2=4×1011mol·L1)
(3)25℃,将amol·L1的HCOONa溶液与0.01mol·L1盐酸等体积混合,反应后测得溶液的pH=7,则Ka=_____________。(用含a的代数式表示不用化简,不考虑液体混合时体积的变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。
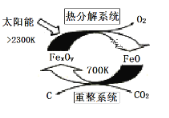
若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为_____。
(2)工业上用CO2和H2反应合成二甲醚。
已知:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H1=-53.7kJ/mol
CH3OCH3(g)+H2O(g)=2CH3OH(g) △H2=+23.4kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的n(CO2)/n(H2)值变小
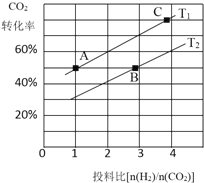
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=________;KA、KB、KC三者之间的大小关系为_________。
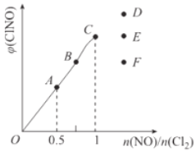
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),2NO(g)+Cl2(g)![]() 2ClNO(g),平衡时ClNO的体积分数的变化图像如图,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。
2ClNO(g),平衡时ClNO的体积分数的变化图像如图,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com