
科目: 来源: 题型:
【题目】在密闭容器中进行如下反应: X2(g)+Y 2(g) ![]() 2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g) ,已知 X 2、Y2、Z 的起始浓度分别为0.1mol/L 、0.3mol/L 、0.2mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A.Z 为 0.3mol/LB.Y2 为 0.4mol/LC.X2 为 0.2mol/LD.Z 为 0.4mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是( )
CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆方向移动
B.加入少量NaOH固体,平衡向正方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正方向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1= -26.7kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2= -50.75kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3= -36.5 kJ·mol-1
则反应FeO(s)+CO(g)=Fe(s)+CO2(g)的焓变为
A.+7.28kJ·mol-1B.7.28kJ·mol-1
C.+43.68kJ·mol-1D.43.68kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
A.CH3﹣CHCl﹣CH2﹣CH3
B.
C.CH3﹣C(CH3)Cl﹣CH2﹣CH3
D.
查看答案和解析>>
科目: 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】铜及其化合物在工农业生产和日常生活中有着广泛的用途。请回答下列问题:
(1)基态铜原子的核外电子排布式为___。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:4NH3+3F2![]() NF3+3NH4F
NF3+3NH4F
①上述化学方程式中的5种物质所属的晶体类型有__![]() 填序号
填序号![]() 。
。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
②F、N、O三种元素的第一电离能由大到小的顺序为__![]() 用元素符号表示
用元素符号表示![]()
(3)铜晶体铜原子的堆积方式为面心立方最密堆积。每个铜原子周围距离最近的铜原子数目为___。
(4)某X原子的外围电子排布式为3s23p5,铜与X形成化合物的晶胞如图所示(黑点代表铜原子)。
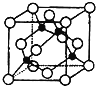
![]() 该晶体的化学式为___。
该晶体的化学式为___。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数的数值为NA,则该晶体中晶胞的棱长为__pm(只写计算式![]() 。
。
(5)合成氨工艺的一个重要工序是铜洗,其目的是用铜液![]() 醋酸二氨合铜(I)、氨水
醋酸二氨合铜(I)、氨水![]() 吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根
吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac(Ac表示醋酸根![]()
①如果要提高上述反应的反应速率,可以采取的措施是___。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
②铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___。
③NH3的氮原子的杂化类型为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,将一定量的A、B、C、D四种物质,置于密闭容器中发生如下反应:

mA(s)+nB(g)![]() pC(g)+qD(g)。达到平衡后,测得B的浓度为0.5mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L,当其它条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是
pC(g)+qD(g)。达到平衡后,测得B的浓度为0.5mol/L。保持温度不变,将密闭容器的容积扩大到原来的两倍,再次达到平衡后,测得B的浓度为0.2mol/L,当其它条件不变时,C在反应混合物中的体积分数(x)与温度(T)、时间(t)的关系如图所示,下列叙述正确的是
A. 容积扩大到原来的两倍,平衡向逆反应方向移动
B. 化学方程式中n>p+q
C. 达到平衡后,若升高温度,平衡向逆反应方向移动
D. 达到平衡后,增加A的量,有利于提高B的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则错误的是( )
bB(g) 达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则错误的是( )
A. 平衡向正反应方向移动了 B. 物质A的转化率增大了
C. 物质B的质量分数增加了 D. a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】Mn3O4是一种高性能结构材料,可由含钙镁离子的硫酸锰浸出液为原料制备。其工艺流程如图所示:
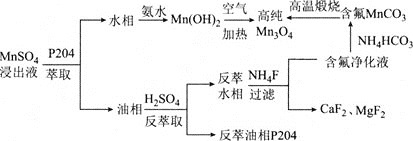
请回答下列问题:
⑴四氧化三锰(Mn3O4)中锰元素的化合价有+2价和+3价,其化学式可改写为________(选项字母)。
A. MnO Mn2O3 B. 2MnO MnO2 C. Mn2O Mn2O3 D. MnO MnO2
⑵是P2O4密度小于水的无色液体,用P2O4萃取碘水中的碘,振荡、静置后的现象为________。
⑶写出由Mn(OH)2制备Mn3O4的化学方程式:________。
⑷通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀完全。若要除去Ca2+、Mg2+,则残留液中c(F-)应不小于_______ mol·L-1,![]() =________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,
=________[已知:Ksp(CaF2) = 2.7×10-11,Ksp(MgF2) =6.5×10-9,![]() ,
,![]() ;保留三位有效数字]。
;保留三位有效数字]。
⑸可由“水相”制备高纯度单质锰,装置如图所示:
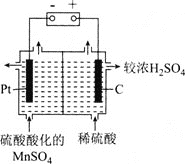
①装置中采用________![]() 填“阴离子”或“阳离子”
填“阴离子”或“阳离子”![]() 交换膜。
交换膜。
②写出该电解反应的化学方程式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温常压下,两个容积相同的烧瓶中分别盛满X和Y两种气体,打开开关a,使两烧瓶内的气体相通,最后容器内的压强由大到小的顺序排列正确的是

编号 | ① | ② | ③ | ④ |
气体X | HI | NH3 | H2 | NO |
气体Y | Cl2 | HCl | Cl2 | O2 |
A. ②>③>①>④ B. ③>①=④>②
C. ③>①>④>② D. ④>①>②>③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com