
科目: 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
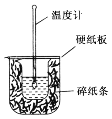
(1)从实验装置上看,图中尚缺少一种玻璃仪器是___。
(2)实验中改用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热___(填“相等”、“偏小”或“偏大”)。
(3)若测得该反应的中和热为57.3kJ/mol,请写出表示中和热的热化学方程式:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】国外宇航员吃着“牙膏和砖块”的时候,中国宇航员已经在太空泡茶了,茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防水珠飘起来。下列说法正确的是(设![]() 为阿伏加德罗常数的值)( )
为阿伏加德罗常数的值)( )
A.水分子中所有原子最外层都满足8电子结构
B.![]()
![]() 中含有非极性键的数目为
中含有非极性键的数目为![]()
C.宇航员喝茶时注入的![]() 的摩尔质量是18g
的摩尔质量是18g
D.氢的三种同位素![]() 、
、![]() 、
、![]() 与
与![]() 可形成多种水分子,其相对分子质量有5种
可形成多种水分子,其相对分子质量有5种
查看答案和解析>>
科目: 来源: 题型:
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过_____方法区分晶体、准晶体和非晶体。
(2)基态铜原子价电子排布的轨道式为______。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为______,依次写出一种与[H2F]+具有相同空间构型和键合形式的分子和阴离子分别是______、______
(4)NH4F(氟化铵)可用于玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是;氟化铵中存在______(填序号):
A.离子键B.σ键C.π键D.氢键
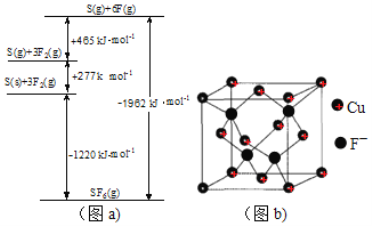
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似于Born-Haber循环能量构建能量图(见图a)计算相联系关键能。则F-F键的键能为kJmol-1,S-F的键能为______kJmol-1。
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1gcm-3。
①CuF比CuCl熔点高的原因是______;
②已知NA为阿伏加德罗常数。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___nm(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸、浓硫酸反应生成SeO2以回收Se。在回收过程中涉及如下化学反应:①SeO2+4KI+4HNO3=Se+2I2+4KNO3+2H2O;②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;③Se+4HNO3(浓)=SeO2+4NO2↑+2H2O;
下列有关叙述正确的是( )
A.氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2
B.反应①中Se是氧化产物,I2是还原产物
C.反应①中生成0.6molI2,转移的电子数目为2.4NA
D.反应②③中等量的Se消耗浓硫酸和浓硝酸中溶质的物质的量之比为2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求完成下列各题。
(1)从下列物质中选择对应类型的物质的序号填空。
①CH3OCH3②HCOOCH2CH3③CH3COCH3④![]() ⑤CH3CHO⑥
⑤CH3CHO⑥![]() ⑦
⑦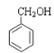
A.属于酯的是__;(填序号,下同)
B.属于酮的是__;
(2)下列各组物质:
①O2和O3;②乙醇和甲醚;③淀粉和纤维素;④苯和甲苯;⑤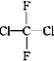 和
和![]()
![]() ;⑥
;⑥ 和
和![]() ;⑦CH3CH2NO2和
;⑦CH3CH2NO2和![]()
A.互为同系物的是__;(填序号,下同)
B.属于同一种物质的是__。
(3)为了测定芳香烃A的结构,做如下实验:
①将9.2g该芳香烃A完全燃烧,生成标况下15.68LCO2和7.2gH2O;
②用质谱仪测定其相对分子质量,得如图所示的质谱图,由图可知该分子的相对分子质量是__,有机物A的分子式为__。
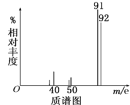
③用核磁共振仪处理该有机物得到四个峰,且四个峰的面积之比是1∶2∶2∶3,则该有机物A的结构简式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中含有丰富的化学元素,图1是某化工厂从海水中提取![]() 、
、![]() (海水中以
(海水中以![]() 形式存在)、
形式存在)、![]() (海水中以
(海水中以![]() 形式存在)等物质的生产流程简图:
形式存在)等物质的生产流程简图:
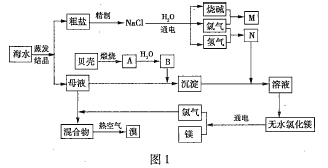
(1)![]() 中加入盐酸后,要获得
中加入盐酸后,要获得![]() 晶体,需要进行的实验操作依次为________(填序号)。
晶体,需要进行的实验操作依次为________(填序号)。
A 蒸馏 B 灼烧 C 过滤 D 蒸发 E 冷却结晶
(2)利用![]() 可制得无水氯化镁,应采取的措施是__________。
可制得无水氯化镁,应采取的措施是__________。
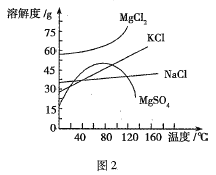
(3)母液中常含有![]() 、
、![]() 、
、![]() 、
、![]() (各物质的溶解度曲线如图2所示)等,进一步加工可制得一些重要的产品。若将母液加热到60℃以上,随着水分的蒸发,会逐渐析出晶体,该晶体的主要成分有________、________;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的________晶体。
(各物质的溶解度曲线如图2所示)等,进一步加工可制得一些重要的产品。若将母液加热到60℃以上,随着水分的蒸发,会逐渐析出晶体,该晶体的主要成分有________、________;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的________晶体。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中站有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔。请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为 ______。
② CaC2中C22-与O22+互为等电子体,1mol O22+中含有的![]() 键数目为 ______。
键数目为 ______。
③乙炔与氢氰酸反应可得丙烯睛(H2C=CH-C≡N),丙烯腈分子中碳原子轨道杂化类型是 ______,构成丙烯腈元素中第一电离能最大的是 ______。
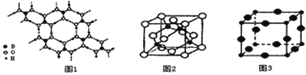
(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1)则1molH3BO3的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______。
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示(黑点代表铜原子,空心圆代表M原子)。
![]() 该晶体化学式为 ______。
该晶体化学式为 ______。
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
(4)Cu3N的晶胞结构如上图3,N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______gcm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】十九大报告提出将我国建设成为制造强国,2020年我国“PX”产能将达到3496万吨/年。有机物(烃)“PX”的结构模型如图,下列说法正确的是( )
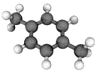
A.“PX”属于脂环烃
B.“PX”的二氯代物共有7种(不考虑立体异构)
C.“PX”分子中,最多有12个原子共面
D.“PX”的同系物均可使酸性KMnO4溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】以石油化工的一种产品A(乙烯)为主要原料合成一种具有果香味的物质E的生产流程如下:
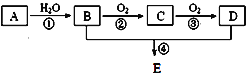
(1)步骤①的化学方程式_____________,反应类型____________。步骤②的化学方程式_____________________,反应类型____________。
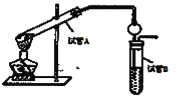
(2)某同学欲用上图装置制备物质E,回答以下问题:
①试管A发生反应的化学方程式_____________。
②试管B中的试剂是__________。
(3)为了制备重要的有机原料——氯乙烷(CH3—CH2Cl),下面是两位同学设计的方案。
甲同学:选乙烷和适量氯气在光照条件下制备,原理是:CH3-CH3+Cl2![]() CH3CH2Cl+HCl。
CH3CH2Cl+HCl。
乙同学:选乙烯和适量氯化氢在一定条件下制备,原理是:CH2=CH2+HCl ![]() CH3CH2Cl。
CH3CH2Cl。
你认为上述两位同学的方案中,合理的是________(选填“甲同学”或“乙同学”),简述你的理由:____
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。请回答下列问题:
(1)甲的化学式是__________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________。
(3)气体丙与金属镁反应的产物是__________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已知Cu2O+2H+=Cu+Cu2++H2O)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com