
科目: 来源: 题型:
【题目】回答下列问题:
(1)已知某链状烷烃分子中电子数为42。则:
①该烷烃的分子式为________________,该烷烃分子的所有同分异构体的结构简式为________________。
②上述同分异构体中,在相同条件下沸点最低的是________________(写结构简式)。
(2)分子式为CaH20的链状烷烃中a为________,分子式为C8Hb的链状烷烃中b为________,与CO2密度(同温同压下)相同的烷烃的分子式为________。若上述三种烃各为1mol,分别在足量O2中燃烧,消耗O2最多的是________(填具体分子式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是( )
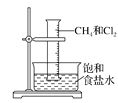
A. 该反应属于取代反应
B. 该反应的条件是光照
C. 该反应的生成物只有四种
D. 该反应现象有量筒内气体颜色变浅,器壁上有油状液滴
查看答案和解析>>
科目: 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
【题目】铁是应用最广泛的金属,铁的卤化物,氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)铁元素在周期表中的位置为_______。
(2)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。则x=_____。
(3)实验室用铁氰化钾确定某铁的氯化物中是否含有FeCl2,该反应的离子方程式为_____。
(4)Fe(OH)3固体与氢碘酸反应时可生成棕色物质的离子方程式为________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_______。
(6)实验室准确称取1.44g草酸亚铁固体,在空气中灼烧,得到0.773g铁的氧化物,写出该铁的氧化物的化学式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。下列实验现象中正确的是( )

A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
查看答案和解析>>
科目: 来源: 题型:
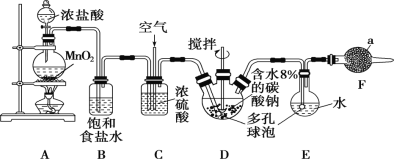
【题目】Cl2O为国际公认的高效安全灭菌消毒剂之一,实验室可利用氯气和空气(氯气与空气体积比为1∶3,空气不参与反应)的混合气与含水8%的碳酸钠反应制备,并用水吸收Cl2O制备次氯酸溶液,所用实验装置和Cl2O的性质如下:
颜色 | 棕黄色 |
状态 | 气体 |
气味 | 强刺激性 |
熔点 | -116 ℃ |
沸点 | 3.8 ℃ |
水溶性 | 极易溶于水,与水反应生成次氯酸 |
热稳定性 | 42 ℃以上分解为Cl2和O2 |
(1)仪器a的名称为________,所盛放的药品是________。
(2)写出装置A中发生反应的离子方程式:_______________。
(3)装置C的主要作用是___________。
(4)装置D、E中都用到多孔球泡,其作用是____________。
(5)写出装置D中Cl2与过量碳酸钠反应生成Cl2O的化学方程式:________。
(6)装置E采用棕色圆底烧瓶的原因是____________。
(7)制备Cl2O装置中存在缺陷,请提出改进措施:___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在常温下,下列电解质溶液的有关叙述正确的是
A.在含有 BaSO4 沉淀的溶液中加入 Na2SO4 固体,c(Ba2+)增大
B.同物质的量浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
C.含 1mol KOH 的溶液与 1mol CO2 完全反应后,溶液中 c(K+)=c(![]() )
)
D.在 CH3COONa 溶液中加入适量 CH3COOH,可使 c(Na+)=c(CH3COO-)
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
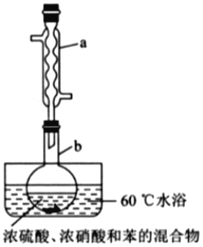
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,再将所得混合物加入苯中
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意请回答有关氮的氧化物和氢化物的问题:
(1)随着人类社会的发展,氮氧化物的排放导致一系列问题。NO形成硝酸型酸雨的化学方程式为_______。一定条件下,用甲烷可以消除氮的氧化物(NOx)的污染。已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574.1 kJ·mol-1,
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160.6 kJ·mol-1则CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH= ___________ 。
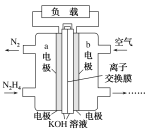
(2)肼(N2H4)可以用作燃料电池的原料。肼的电子式为_________,一种以液态肼为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。b电极是_____极(填“正”或“负”),a电极的电极反应式:__________________。
(3)25 ℃时,Kb(NH3·H2O)=1.8×10-5 mol·L-1,向含a mol NH4NO3的溶液中滴加b L氨水呈中性,则所滴加氨水的浓度为___________。
(4)在体积恒定的密闭容器中有可逆反应: 2NO(g)+O2(g) ![]() 2NO2(g) ΔH<0 ,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150 ℃时,v(正)________v(逆)(填“>”或“<”)。
2NO2(g) ΔH<0 ,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如图,则150 ℃时,v(正)________v(逆)(填“>”或“<”)。
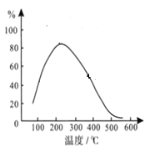
(5)判断在恒温恒容条件下该反应已达到平衡状态的是_____
A 2v正(NO2)=v逆(O2) B 反应容器中压强不随时间变化而变化
C 混合气体颜色深浅保持不变 D 混合气体平均相对分子质量保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com