
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
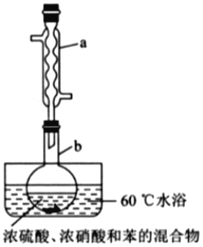
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应向浓硝酸中加入浓硫酸,待冷却至室温后,再将所得混合物加入苯中
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
CO(g)+H2(g)在一密闭容器中进行,下列说法正确是
A.保持容器体积不变,增加C的物质的量,反应速率增大
B.保持容器体积不变,充入N2容器内气体压强增大,化学反应速率增大
C.保持压强不变,充入N2容器内气体压强不变,化学反应速率减小
D.保持容器体积不变,随着反应进行气体物质的量增多,压强增大,反应速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,用0.0200mol/L稀盐酸滴定20.00mL0.0200mol/LNaY溶液,溶液中水的电离程度随所加稀盐酸的体积变化如图所示(忽略滴定过程中溶液的体积变化),则下列有关说法正确的是
已知:K(HY)=5.0×10-11

A. 可选取酚酞作为滴定指示剂 B. M点溶液的pH>7
C. 图中Q点水的电离程度最小,Kw<10-14 D. M点,c(Na+)=c(HY)+c(Y-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应2HI(g)![]() H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
H2(g)+ I2(g)(正反应吸热)达到平衡时,要使混合气体的颜色加深,可采取的措施是: ①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强
A. ①③⑥ B. ③⑤⑥ C. ①③⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.标准状况下,22.4L二氯甲烷的分子数约为NA
B.乙烯和丙烯组成的42g混合气体中含碳原子数为6NA
C.1mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为12NA
D.将1molCH3COONa溶于稀醋酸中溶液呈中性,溶液中CH3COO-数目等于NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
2C(g) ΔH=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
平衡时n(C)/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A.K1=K2<K3
B.升高温度能加快反应速率的原因是降低了反应的活化能
C.实验Ⅱ比实验Ⅰ达平衡所需时间小的可能原因是使用了催化剂
D.实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molC,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: (1)Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
CO2(g)+2Fe(s),ΔH=+234.1kJmol-1
![]() 则
则![]() 的ΔH是( )
的ΔH是( )
A.-824.4 kJmol-1B.-627.6kJmol-1C.-744.7kJmol-1D.-169.4kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是将SO2 转化为重要的化工原料H2SO4的原理示意图。

请回答下列问题:
(1)该装置将________能转化为________能,电流方向为________(填“b→a”或“a→b”)。
(2)催化剂b表面O2发生___________反应,其附近酸性________(填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_________________________________________。
(4)若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL 14 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.与铜镁合金反应的HNO3的物质的量为0.12 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com