
【题目】1.52 g铜镁合金完全溶解于50 mL 14 mol/L的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.与铜镁合金反应的HNO3的物质的量为0.12 mol
【答案】B
【解析】
A.金属离子全部沉淀时,得到2.54克沉淀为氢氧化铜和氢氧化镁,故沉淀中的氢氧根离子的质量为2.54-1.52=1.02克,其物质的量为![]() ,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,设铜和镁合金中铜和镁的物质的量分别为xmol、ymol,则有2x+2y=0.06 64x+24y=1.52,解x=0.02, y=0.01。则该合金中铜和镁的物质的量比为2:1,故正确;
,根据电荷守恒可知,金属提供的电子的物质的量等于氢氧根离子的物质的量,设铜和镁合金中铜和镁的物质的量分别为xmol、ymol,则有2x+2y=0.06 64x+24y=1.52,解x=0.02, y=0.01。则该合金中铜和镁的物质的量比为2:1,故正确;
C.标况下1.12L气体的物质的量为![]() ,设混合气体中的二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,则混合气体中含有二氧化氮0.04mol,四氧化二氮0.01mol,二氧化氮和四氧化二氮的混合气体中,二氧化氮的体积分数为
,设混合气体中的二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,则混合气体中含有二氧化氮0.04mol,四氧化二氮0.01mol,二氧化氮和四氧化二氮的混合气体中,二氧化氮的体积分数为![]() =80%,故正确;B.50mL硝酸中含有硝酸的物质的量为14mol/L×0.05L=0.7mol,反应后的溶质为硝酸钠,根据氮元素守恒,硝酸钠的物质的量为0.05L×14 mol/L -0.04 mol -(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为
=80%,故正确;B.50mL硝酸中含有硝酸的物质的量为14mol/L×0.05L=0.7mol,反应后的溶质为硝酸钠,根据氮元素守恒,硝酸钠的物质的量为0.05L×14 mol/L -0.04 mol -(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为![]() ,故错误;
,故错误;
D.铜和镁的物质的量分别为0.02、0.01mol,则生成硝酸铜和硝酸镁各0.02 mol、0.01mol,二氧化氮和四氧化二氮的物质的量为0.05mol,含有二氧化氮0.04mol,四氧化二氮0.01mol,则消耗硝酸的物质的量为0.02×2+0.01×2+0.04+0.01×2=0.12mol,故正确。
故选B 。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】《hem Commun》报导,MarcelMayorl合成的桥连多环烃(![]() ),拓展了人工合成自然产物的技术。下列有关该烃的说法正确的是( )
),拓展了人工合成自然产物的技术。下列有关该烃的说法正确的是( )
A. 属于饱和烃,常温时为气态B. 二氯代物共有5种
C. 分子中含有4个五元环D. 不存在属于苯的同系物的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A.4v(NH3)=5v(O2)B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O)D.4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验过程中需注重环境保护,下列操作不会引起空气污染的是
A. 加热KMnO4制氧气的试管,用浓盐酸洗涤
B. 用稀硝酸洗涤做过银镜实验的试管
C. 硝酸亚铁和硫酸废液一同倒入废液缸
D. 将打破的水银温度计用硫粉覆盖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(1)写出上述实验中发生反应的化学方程式:______。
(2)实验结果表明,催化剂的催化效果与_____有关。
(3)某同学在10 mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图所示,则A、B、C三点所表示的反应速率最慢的是_____。

Ⅱ.某反应在体积为5L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
(4)该反应的的化学方程式为__________。
(5)反应开始至2分钟时,B的平均反应速率为____。
(6)能说明该反应已达到平衡状态的是____。
a.v(A)= 2v(B) b.容器内各物质的物质的量相等
c.v逆(A)=v正(C) d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数______。
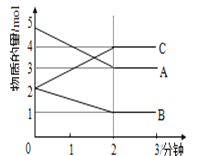
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
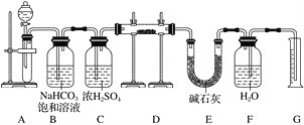
回答下列问题:
(1)装置A中液体试剂选用________________。
(2)装置B的作用是_________。装置E中碱石灰的作用是________。
(3)装置D中发生反应的化学方程式是__________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和铁的氧化物等杂质)为原料制备铝与硫酸亚铁,工艺流程如图所示:请回答下列问题:
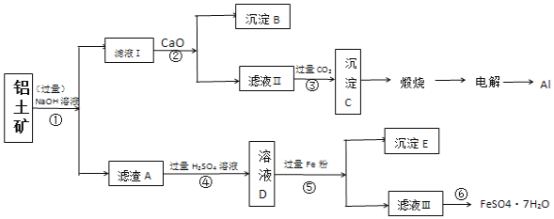
(1)步骤①中提高碱浸速率的方法_______。
(2)滤液Ⅰ中主要的阴离子是______。
(3)步骤⑤加入过量的铁粉的目的___(用离子方程式解释)
(4)检验滤液Ⅲ中的金属阳离子的方法是:_____。
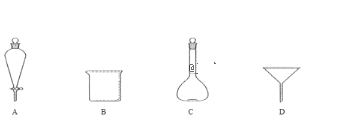
(5)滤液Ⅲ经过蒸发浓缩,_______,过滤得到硫酸亚铁晶体,过滤时需要的玻璃仪器有___(填标号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com