
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 (2008?佛山一模)选做题:精神病学专家通过实验发现:在大脑的相应部位-“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图.请回答下列问题:
(2008?佛山一模)选做题:精神病学专家通过实验发现:在大脑的相应部位-“奖赏中心”,给予柔和的电击,便会处于似乎极度快乐的状态.人们已经将“奖赏中心”部分的脑电图绘制出来,并认为,在各区域之间传递信息的化学物质是多巴胺,所以“奖赏中心”又称为多巴胺系统.多巴胺结构如图.请回答下列问题:






查看答案和解析>>
科目: 来源: 题型:
| △ |




查看答案和解析>>
科目: 来源: 题型:
| 电解 |
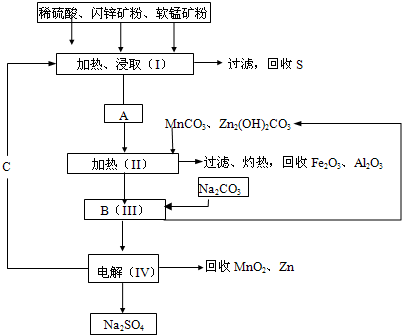
查看答案和解析>>
科目: 来源: 题型:
 (2008?佛山一模)(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成
(2008?佛山一模)(1)合成氨工业对化学工业和国防工业具有重要意义.工业合成| 20-50MPa | 500℃、铁触煤 |
查看答案和解析>>
科目: 来源: 题型:阅读理解
 (2008?佛山一模)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:
(2008?佛山一模)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.请就“三大酸”与金属铜反应的情况,回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
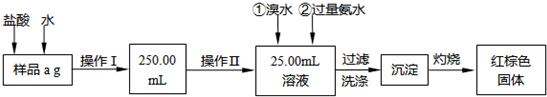
| 112(W2-W1) |
| 160a |
| 112(W2-W1) |
| 160a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com