


科目:高中化学 来源: 题型:阅读理解
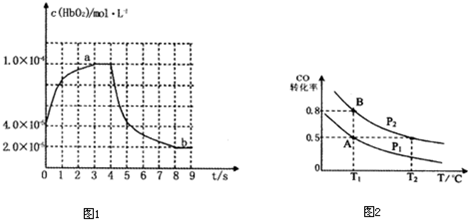
| 1 |
| 10000 |
| 1 |
| 10000 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
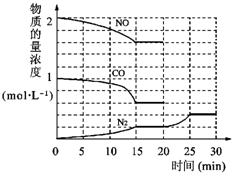 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1| 0.4 |
| 15 |
| 0.4 |
| 15 |
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
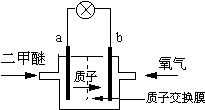 哥本哈根气候变化峰会自2009年12月7日开幕以来,就被冠以“有史以来最重要的会议”、“改变地球命运的会议”等各种重量级头衔.纵然世界各国仍就减排问题进行着艰苦的角力,但低碳这个概念几乎得到了广泛认同.中国慈善首富陈光标2010年11月5号创作的低碳之歌--《让我们再回到从前》让低碳概念融入到每个人的生活之中,减碳是每个人的责任.新能源开发中的燃料电池是低碳研究的重要领域.
哥本哈根气候变化峰会自2009年12月7日开幕以来,就被冠以“有史以来最重要的会议”、“改变地球命运的会议”等各种重量级头衔.纵然世界各国仍就减排问题进行着艰苦的角力,但低碳这个概念几乎得到了广泛认同.中国慈善首富陈光标2010年11月5号创作的低碳之歌--《让我们再回到从前》让低碳概念融入到每个人的生活之中,减碳是每个人的责任.新能源开发中的燃料电池是低碳研究的重要领域.查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 molNO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。(2分)
(2)已知:
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H= kJ·mol-1 (2分)
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g)2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,则前5分钟的平均反应速率v(N2)为 ,平衡时H2的转化率为 ,该反应的平衡常数K= 。(6分)
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g)2NH3(g) △H<0的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
则K1 K2(填写“>”、“=”或“<”)(2分)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是
(填字母)(2分)
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d.. 混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省梅州市高三总复习质检二理综化学试卷(解析版) 题型:计算题
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g)  CH3CH2OH(g) + H2O(g)
△H = —256.1 kJ·mol-1
CH3CH2OH(g) + H2O(g)
△H = —256.1 kJ·mol-1
已知:CO(g) + H2O(g)  CO2(g)+H2(g)
△H= —41.2 kJ·mol-1
CO2(g)+H2(g)
△H= —41.2 kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g)  CH3CH2OH(g) +3H2O(g)
△H = 。
CH3CH2OH(g) +3H2O(g)
△H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。

②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g)
 N2 (g) + CO2
(g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2
(g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
浓度/mol∙L-1 时间/min |
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com