
科目: 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)已知元素M是组成物质Ca5(PO4)3F的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号I1至I表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
电离能(kJ/mol) | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是___________价,其基态原子电子排布式为___________。
(2)往硫酸铜溶液中加入过量氨水,可形成[Cu(NH3)4]SO4,溶液,该溶液可用于溶解纤维素。
①[Cu(NH3)4]SO4中阴离子的立体构型是___________。
②除硫元素外,[Cu(NH3)4]SO4中所含元素的电负性由小到大的顺序为___________。
③NF3与NH3的空间构型相同,中心原子的轨道杂化类型均为___________。但NF3不易与Cu2+形成化学键,其原因是___________。
(3)一种Hg-Ba-Cu-O高温超导材料的晶胞(长方体)如图所示。

①该物质的化学式为___________。
②已知该晶胞中两个Ba2+的间距为cpm。则距离Ba2+最近的Hg+数目为___________个,二者的最短距离为___________pm。(列出计算式即可,下同)
③设该物质的摩尔质量为M,阿伏加德罗常数的值为NA,则该晶体的密度为___________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀硫酸25mL,滴定终点时消耗NaOH溶液15mL。
(1)该学生用标准0.14mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO425mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
①滴定操作的正确顺序是(用序号填写):________。
②该滴定操作中应选用的指示剂是:_______。
③在G操作中如何确定终点?________。
(2)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度______mol/L。(计算出结果到小数点后二位)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】缓冲和供氧是维持人体正常生理活动的两个重要平衡系统,回答下列问题:
Ⅰ.人体血液中存在平衡:H2CO3 (aq)![]() H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
H+(aq)+HCO3-(aq) △H,该平衡可使血液的pH维持在一定范围内。
(1)已知:
CO2(g)![]() CO2(aq) △H1=akJ·mol-l;
CO2(aq) △H1=akJ·mol-l;
CO2(aq)+H2O(l)![]() H2CO3 (aq) △H2=bkJ mol-1;
H2CO3 (aq) △H2=bkJ mol-1;
HCO3-(aq)![]() H+(aq)+CO32-(aq) △H3=ckJ mol-1;
H+(aq)+CO32-(aq) △H3=ckJ mol-1;
CO2(g)+H2O(l)![]() 2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
2H+(aq)+CO32-(aq) △H4=dkJ mol-1。
则上述电离方程式中△H =_____________(用含a、b、c、d的代数式表示)。
(2)若某人血液中c(HCO3-):c(H2CO3)=20:1,pKa1(H2CO3)=6.1,则该人血液的pH=_____________,pH升高,则![]() ___(填“增大”“减小”或“不变”)。
___(填“增大”“减小”或“不变”)。
(3)当有少量酸性物质进入血液后,血液的pH变化不大,用平衡移动原理解释上述现象:_____________。
Ⅱ.肌细胞石储存氧气和分配氧气时存在如下平衡:
Mb(aq)+O2(g)![]() MbO2(aq)。
MbO2(aq)。
肌红蛋白 氧合肌红蛋白
(4)经测定动物体温升高,氧气的结合度[α(MbO2),氧合肌红蛋白的浓度占肌红蛋白初始浓度的百分数]降低,则该反应的△H_______________(填“>”或“<”)0。
(5)温度为37 ℃时,氧气的结合度[α(MbO2)与氧气的平衡分压[p(O2)]关系如下图所示:
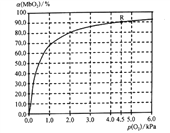
①利用R点所示数据,计算37 ℃时该反应的平衡常数K=_________________(氧气的平衡浓度可用氧气的平衡分压代替求算)。
②已知37 ℃时,该反应的正反应速率v(正)=k1c(Mb)×p(O2),逆反应速率v(逆)=k2c(MbO2),若k2=60s-1,则k1=___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述中,合理的是
A.用已知浓度的NaOH溶液测定盐酸的浓度,酸式滴定管未用待装溶液润洗会造成测定结果偏高
B.![]() 溶液中:
溶液中:![]()
C.等体积等浓度的氢氧化钠与醋酸混合:![]()
D.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液和
溶液和![]() 溶液:
溶液:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】现有浓度均为0.01mol/L的盐酸、硫酸、醋酸三种溶液,回答下列问题:
(1)分别用以上三种酸中和一定量(且等量)的NaOH溶液生成正盐,若需要酸的体积分别为V1、V2、V3,其大小关系为__________________。
(2)分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为________。
(3)将以上三种酸稀释1000倍后,pH分别变成a,b,c,其大小关系为_____________
(4)将上述盐酸稀释106倍后,c(H+): c(Cl-)= ___________
(5)常温下,某浓度的盐酸和NaOH溶液的pH之和为16,当它们按一定体积比混合时,溶液的pH恰好等于7,则A与B的体积比是 _____________
查看答案和解析>>
科目: 来源: 题型:
【题目】由W、X、Y、Z四种金属按下列装置进行实验。下列说法不正确的是
甲 | 乙 | 丙 | |
装置 |
|
|
|
现象 | 金属W不断溶解 | Y 的质量增加 | W上有气体产生 |
A.装置甲中W作原电池负极
B.装置乙中Y电极上的反应式为Cu2++2e=Cu
C.装置丙中溶液的c(H+)不变
D.四种金属的活动性强弱顺序为Z>W>X>Y
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是
A.向0.10mol·L-1 NH4HCO3溶液中通CO2:c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
B.向0.10mol·L-1 NaHSO3溶液中通NH3:c (Na+)>c(![]() )>c(
)>c(![]() )
)
C.向0.10mol·L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2SO3)]
)+c(H2SO3)]
D.向0.10mol·L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中有关物质的物质的量浓度的大小关系正确的是
A.常温下,在![]() 的HCOONa溶液中:
的HCOONa溶液中:![]()
B.![]() 溶液中:
溶液中:![]()
C.室温下,由![]() 的
的![]() 溶液与
溶液与![]() 的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:
的NaOH溶液等体积混合,溶液中离子浓度大小的顺序为:![]()
D.相同物质的量浓度的下列溶液中,①![]() 、②
、②![]() 、③
、③![]() 、④
、④![]() ;
;![]() 由大到小的顺序是:②>①>③>④
由大到小的顺序是:②>①>③>④
查看答案和解析>>
科目: 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com