
科目: 来源: 题型:
【题目】化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如下图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
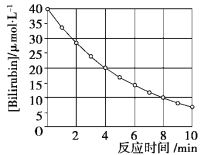
A.2.5 μmol·L-1·min-1和2.0 μmol·L-1
B.2.5 μmol·L-1·min-1和2.5 μmol·L-1
C.3.0 μmol·L-1·min-1和3.0 μmol·L-1
D.5.0 μmol·L-1·min-1和3.0 μmol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3具有净水作用,而高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,处理污水比FeCl3高效。请回答下列问题:已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3
(1)FeCl3净水的原理是______。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为______(填写数值)。
(2)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=______molL-1。
(3)FeCl3在溶液中分三步水解:
Fe3++H2OFe(OH)2++H+ K1
Fe(OH)2++H2O![]() +H+ K2
+H+ K2
![]() +H2OFe(OH)3+H+ K3
+H2OFe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_________。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() +yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
a.降温 b.加水稀释 c. 加入NaHCO3d.加入NH4Cl
(4)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图所示:
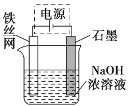
①电解过程中阳极的电极反应式为______。
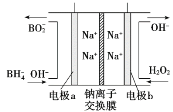
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图所示。电极a与甲池中_______(填“石墨”或“铁丝网”)连接,电极b的反应式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒温恒容下,某容器中进行如下反应:H2![]() 2H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
2H。若反应物的浓度由0.1mol·L-1降到0.06mol·L-1需20s,那么由0.06mol·L-1降到0.024mol·L-1需反应的时间为( )
A.等于18sB.等于12sC.大于18sD.小于18s
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问題。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;水的电离程度将________(填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________(填字母)。
a.![]() 、
、![]() b.
b.![]() 、
、![]() c.
c.![]() 、
、![]() d.H2SO3、
d.H2SO3、![]()
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______。
(4)0.1 mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中 c(H2A)________c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________(用文字解释)。
查看答案和解析>>
科目: 来源: 题型:
【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是 ______。
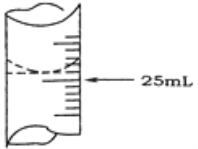
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为______________ 。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.22 | 26.31 |
(3)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为_____________ (小数点后保留四位)。
(4)下列哪些操作会使测定结果偏高(_________) (填序号)。
A.锥形瓶用蒸馏水洗净后,直接注入待测溶液进行滴定
B.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
C.碱式滴定管用蒸馏水洗涤后立即取用25.00mL待测液注入锥形瓶中进行滴定
D.滴定前俯视滴定管读数,滴定后平视滴定管读数
(5)滴定达到终点的标志是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)![]() NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g)![]() H2(g)+HI(g)
H2(g)+HI(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下,反应①的平衡常数为
A.9B.16C.20D.25
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,N2O分解的部分实验数据如下( )
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O)/molL-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
A.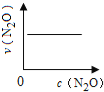 B.
B.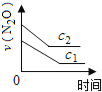 C.
C.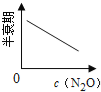 D.
D.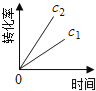
查看答案和解析>>
科目: 来源: 题型:
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )
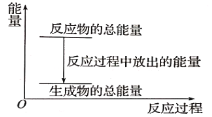
A. 反应过程中的能量关系可用上图表示
B. 1 mol Zn的能量大于1 mol H2的能量
C. 若将其设计为原电池,则其能量转化形式为电能转化为化学能
D. 若将其设计为原电池,当有32.5gZn溶解时,正极放出的气体一定为11.2L.
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL 0.1 mol·L-1CH3COOH溶液中滴加0.1mol·L-1的NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
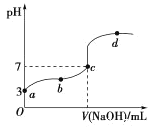
A.c点对应的V(NaOH)<20mL
B.a点表示的溶液中由水电离出的H+浓度为1.0![]() 10-11mol·L-1
10-11mol·L-1
C.b点表示的溶液中 c(CH3COO -)>c(Na+)
D.b、d点表示的溶液中c(CH3COO-)与c(CH3COOH)的比值相等
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向50 mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下图所示。下列说法正确的是

A. 若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
B. 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C. b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
D. 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com