
科目: 来源: 题型:
【题目】某有机物X的结构简式如图所示,下列有关说法不正确的是
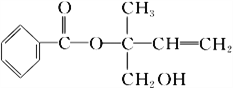
A. X分子中含有三种官能团
B. 可用酸性高锰酸钾溶液区别苯和X
C. X在一定条件下能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 mol X最多能与5 mol H2加成
查看答案和解析>>
科目: 来源: 题型:
【题目】CO是大气污染气体,可利用化学反应进行治理或转化。
(1)甲醇是重要的溶剂和燃料,工业上用CO和H2在一定条件下制备CH3OH的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
①T℃时,向容积为2 L的恒容密闭容器中充入1 mol CO和1.2 mol H2,一段时间后达到平衡,此时H2与CH3OH的体积分数之比为2∶5,该反应的平衡常数K=____;此时若向容器中再通入0.4 mol CO和0.2 mol CH3OH(g),则平衡将____移动。(填“向正反应方向”、“不”或“向逆反应方向”)
②在一容积可变的密闭容器中充入一定物质的量的CO和H2,测得CO在不同温度下的平衡转化率与压强的关系如图所示。a、b、c三点平衡常数K(a)、K(b)、K(c)的大小关系是____。b、d两点的正反应速率vb(CO)____vd(CO)。

(2)沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。如图表示在相同的恒容密闭容器、相同起始浓度、反应相同的时间,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。

①a、b、c、d四点中表示平衡状态的是____;
②相同条件下,____型沥青混凝土催化效果更佳;
③e点转化率出现突变的原因可能是____。
查看答案和解析>>
科目: 来源: 题型:
【题目】合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g) H,测得压强、温度对CO、CO2的平衡组成的影响如图所示,回答下列问题:
2CO(g) H,测得压强、温度对CO、CO2的平衡组成的影响如图所示,回答下列问题:

(1)p1、p2、p3的大小关系是________,图中a、b、c三点对应的平衡常数大小关系是______________________。
(2)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:反应1:CO(g)+3H2(g) ![]() CH4(g)+H2O(g) H1= a kJ/mol
CH4(g)+H2O(g) H1= a kJ/mol
反应2:CO(g)+H2O(g) ![]() CO2(g)+H2(g) H2= b kJ/mol
CO2(g)+H2(g) H2= b kJ/mol
① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是____________。
② 已知298 K时相关化学键键能数据为:
化学键 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
则根据键能计算,H1=________________。反应1自发进行的条件是___________。(填“较高温度”、“较低温度”、“任意温度”)
(3)一定条件下,CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K =_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
CH3OH(g)+H2O(g) ΔH3,向固定容积为1 L的密闭容器中充入2 mol CO2和6 mol H2,一段时间后达到平衡状态,测得CH3OH(g)的物质的量为1mol,则此条件下该反应的化学平衡常数K =_________(用分数表示);若开始时充入2 mol CH3OH(g) 和2 mol H2O(g)达到相同平衡状态时,CH3OH的转化率为_______;若平衡后再充入4 mol的N2,则c(CO2)和原平衡比较是_________。(填“增大”、“减小”、“不变”)
(4)如图是甲醇燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。

①甲中负极的电极反式为_______________,丙中C极的电极反应式为___________。
② 乙中A极析出的气体在标准状况下的体积为__________________。
查看答案和解析>>
科目: 来源: 题型:
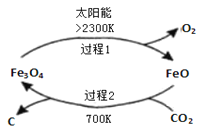
【题目】![]() 是燃烧和代谢的最终产物,也是造成温室效应的废气,但
是燃烧和代谢的最终产物,也是造成温室效应的废气,但![]() 作为一种资源,开发和利用的前景十分诱人.
作为一种资源,开发和利用的前景十分诱人.
I、利用太阳能,以![]() 为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
II、近年科学家提出“绿色自由”构想.把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成.其工艺流程如图所示:
反应生成.其工艺流程如图所示:

![]() 由吸收池导入分解池中的主要物质的化学式是______.
由吸收池导入分解池中的主要物质的化学式是______.
![]() 上述流程中______
上述流程中______![]() 填化学式
填化学式![]() 可循环使用,体现了该流程的“绿色”.
可循环使用,体现了该流程的“绿色”.
![]() 不同温度下,在1L恒容密闭容器中充入2mol
不同温度下,在1L恒容密闭容器中充入2mol![]() 和5mol
和5mol![]() ,相同时间内测得
,相同时间内测得![]() 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

![]() 合成塔中发生的化学反应方程式为______.
合成塔中发生的化学反应方程式为______.
![]() 时a点(正)______ (逆)(填“
时a点(正)______ (逆)(填“![]() ”,“
”,“![]() ”,“
”,“![]() ”);
”);
![]() 计算温度为
计算温度为![]() 时b的平衡常数为______.
时b的平衡常数为______.
![]() 为检验吸收池中饱和
为检验吸收池中饱和![]() 溶液是否充足,量取100mL吸收液用
溶液是否充足,量取100mL吸收液用![]() 盐酸滴定,生成的
盐酸滴定,生成的![]() 标准状况下
标准状况下![]() 随
随![]() 盐酸
盐酸![]() 变化关系如图所示:
变化关系如图所示:

则该100mL吸收液还可吸收标准状况下______![]() .
.
Ⅲ![]() 以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将
以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将![]() 转化为低碳烯烃,工作原理如图所示.
转化为低碳烯烃,工作原理如图所示.

![]() 的移动方向是______
的移动方向是______![]() 填从左至右或从右至左
填从左至右或从右至左![]()
![]() 产生乙烯的电极反应式为______.
产生乙烯的电极反应式为______.
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4 + 5H2C2O4 + 3H2SO4= K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
(实验内容及记录)
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | V1 | 2.7 |
3 | 1.0 | V2 | 2.0 | 3.0 | 3.9 |
请回答:(1)表中V1=___________,V2=___________。
(2)根据上表中的实验数据,可以得到的结论是_____________________________。
(3)利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)= ________________________。
(4)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。(忽略反应过程中温度变化)
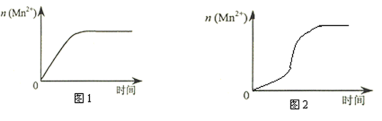
①该小组同学提出的假设是_______________________________________。
②请你帮助该小组同学完成实验方案。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05 mol/L KMnO4溶液 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | A | t |
表中加入的固体A是_______________。(写化学式)
③若该小组同学提出的假设成立,应观察到的现象是____________
(5)工业上可用电解K2MnO4溶液的方法制取KMnO4,则电解时,阳极发生的电极反应式为____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()

A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为![]() 时,在三个容积均为
时,在三个容积均为![]() 的恒容密闭容器中仅发生反应:
的恒容密闭容器中仅发生反应:![]() 正反应吸热
正反应吸热![]() 。实验测得:
。实验测得:![]() ,
,![]() ,
,![]() 、
、![]() 为速率常数,受温度影响。平衡常数
为速率常数,受温度影响。平衡常数![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数。下列说法不正确的是
物质的量分数。下列说法不正确的是![]()
![]()
容器 编号 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| |
Ⅰ |
| 0 | 0 |
|
Ⅱ |
|
|
| |
Ⅲ | 0 |
|
| |
A.达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的小
比容器Ⅰ中的小
B.容器Ⅱ反应达平衡前,![]()
C.起始时容器Ⅰ中总压强为![]() ,则
,则![]() 时该反应的平衡常数
时该反应的平衡常数![]() kPa
kPa
D.当温度改变为![]() 时,若
时,若![]() 则
则![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在固定容积为 5L 的密闭容器中发生可逆反应:C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)请写出该反应的化学平衡常数表达式 K= ________________________ 。
(2)不能判断该反应一定达到化学平衡状态的依据是_____________(填字母)
A.υ正(H2O)=υ逆(H2)
B.消耗 n mol H2 的同时消耗 n mol CO
C.容器中混合气体的密度不随时间而变化
D.混合气体的压强不再变化
(3)若在固定容积为 5L 的密闭容器中加入的是 2 mol Fe(s)与 1 mol H2O(g),发生反应: 3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g),△H<0,t1 秒时,H2 的物质的量为 0.2 mol,到 t2 秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
Fe3O4(s)+4H2(g),△H<0,t1 秒时,H2 的物质的量为 0.2 mol,到 t2 秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
①t1~t2这段时间内的反应速率υ(H2O)=____;达到平衡时,H2的体积分数为____。
②若继续加入 2 mol Fe(s),则平衡___________移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1molH2O再次达到平衡后,H2的物质的量为___________。
③该反应的逆反应速率随时间变化的关系如图:

t1时改变了某种条件,改变的条件可能是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Fenton法常用于处理含难降解有机物的工业废水,往调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p﹣CP,控制p﹣CP的初始浓度相同,恒定实验温度在298K或313K进行实验。实验测得p﹣CP的浓度随时间变化的关系如图所示,下列说法不正确的是( )

A.由①可得,降解反应在50~150s内的反应速率:v(pCP)=8.0×10﹣6molL﹣1s﹣1
B.升高温度,有利于加快降解反应速率,但温度过高反应速率又会变慢
C.③目的为探究溶液的pH对降解反应速率的影响
D.298K下,有机物p﹣CP降解速率pH=10时比pH=3快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com