
【题目】![]() 是燃烧和代谢的最终产物,也是造成温室效应的废气,但
是燃烧和代谢的最终产物,也是造成温室效应的废气,但![]() 作为一种资源,开发和利用的前景十分诱人.
作为一种资源,开发和利用的前景十分诱人.
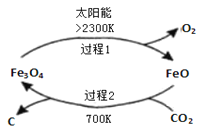
I、利用太阳能,以![]() 为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
II、近年科学家提出“绿色自由”构想.把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成.其工艺流程如图所示:
反应生成.其工艺流程如图所示:

![]() 由吸收池导入分解池中的主要物质的化学式是______.
由吸收池导入分解池中的主要物质的化学式是______.
![]() 上述流程中______
上述流程中______![]() 填化学式
填化学式![]() 可循环使用,体现了该流程的“绿色”.
可循环使用,体现了该流程的“绿色”.
![]() 不同温度下,在1L恒容密闭容器中充入2mol
不同温度下,在1L恒容密闭容器中充入2mol![]() 和5mol
和5mol![]() ,相同时间内测得
,相同时间内测得![]() 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

![]() 合成塔中发生的化学反应方程式为______.
合成塔中发生的化学反应方程式为______.
![]() 时a点(正)______ (逆)(填“
时a点(正)______ (逆)(填“![]() ”,“
”,“![]() ”,“
”,“![]() ”);
”);
![]() 计算温度为
计算温度为![]() 时b的平衡常数为______.
时b的平衡常数为______.
![]() 为检验吸收池中饱和
为检验吸收池中饱和![]() 溶液是否充足,量取100mL吸收液用
溶液是否充足,量取100mL吸收液用![]() 盐酸滴定,生成的
盐酸滴定,生成的![]() 标准状况下
标准状况下![]() 随
随![]() 盐酸
盐酸![]() 变化关系如图所示:
变化关系如图所示:

则该100mL吸收液还可吸收标准状况下______![]() .
.
Ⅲ![]() 以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将
以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将![]() 转化为低碳烯烃,工作原理如图所示.
转化为低碳烯烃,工作原理如图所示.

![]() 的移动方向是______
的移动方向是______![]() 填从左至右或从右至左
填从左至右或从右至左![]()
![]() 产生乙烯的电极反应式为______.
产生乙烯的电极反应式为______.
【答案】6FeO+CO2 ![]() 2Fe3O4+C
2Fe3O4+C ![]()
![]() CO2+3H2
CO2+3H2 ![]() CH3OH+H2O > 800 56 从右到左
CH3OH+H2O > 800 56 从右到左 ![]()
【解析】
Ⅰ.过程2是FeO和CO2反应生成Fe3O4和C;
Ⅱ.空气中的CO2与K2CO3溶液生成KHCO3,碳酸氢钾不稳定,在分解池中加热分解生成碳酸钾和二氧化碳、水,二氧化碳与氢气合成甲醇。
(1)①吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3;
②由分解池分解后所得溶液是碳酸钾可通入吸收池再利用分析解答;
(2)①在1L恒容密闭容器中充入2mol CO2和5mol H2反应生成甲醇和水;
②根据图像,T1时,a点的二氧化碳的转化率增大,说明a点反应正向进行;
③b点二氧化碳转化率为80%,根据三段式列式计算平衡浓度,再计算平衡常数;
(3)盐酸滴加到碳酸钾溶液中开始反应生成碳酸氢钾和氯化钾,随后发生反应碳酸氢钾和盐酸反应生成二氧化碳气体,据此计算碳酸钾物质的量,碳酸钾和二氧化碳、水反应生成碳酸氢钾,据此计算吸收二氧化碳的体积;
Ⅲ.(1)电解池中氢氧根离子在阳极失电子发生氧化反应生成氧气,故a是负极,b为正极,阳离子移向阴极;
(2)太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,乙烯在阴极生成。
Ⅰ.过程2是FeO和CO2反应生成Fe3O4和C,故化学方程式为6FeO+CO2 ![]() 2Fe3O4+C,故答案为:6FeO+CO2
2Fe3O4+C,故答案为:6FeO+CO2 ![]() 2Fe3O4+C;
2Fe3O4+C;
Ⅱ.(1)①吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3;
故答案为:KHCO3;
②吸收池中的反应为:K2CO3+H2O+CO2=2KHCO3,分解池中的反应为:2KHCO3 ![]() K2CO3+H2O+CO2↑,可见碳酸钾可重复利用,循环的方向为分解池指向吸收池。故答案为:K2CO3;
K2CO3+H2O+CO2↑,可见碳酸钾可重复利用,循环的方向为分解池指向吸收池。故答案为:K2CO3;
(2)①在1L恒容密闭容器中充入2mol CO2和5mol H2反应生成甲醇和水,反应的化学方程式为:CO2+3H2 ![]() CH3OH+H2O,故答案为:CO2+3H2
CH3OH+H2O,故答案为:CO2+3H2 ![]() CH3OH+H2O;
CH3OH+H2O;
②根据图像,T1时,a点的二氧化碳的转化率增大,反应正向进行,则(正)>(逆),故答案为:>;
③b点二氧化碳转化率为80%,
CO2 + 3H2 ![]() CH3OH+H2O
CH3OH+H2O
起始量(mol/L) 2 5 0 0
变化量(mol/L) 1.64.8 1.61.6
平衡量(mol/L) 0.4 0.2 1.61.6
K=![]() =800,故答案为:800;
=800,故答案为:800;
(3)图象分析可知发生反应K2CO3+HCl=KHCO3+KCl,消耗25mL盐酸其物质的量=0.1mol/L×0.025L=0.0025mol,发生反应KHCO3+HCl=KCl+CO2↑+H2O,消耗盐酸75mL,物质的量=0.1mol/L×0.075L=0.0075mol,则100mL吸收液中含碳酸钾0.0025mol,吸收二氧化碳发生反应K2CO3+CO2+H2O=2KHCO3,吸收二氧化碳物质的量为0.0025mol,标准状况下的体积=0.0025mol×22.4L/mol=0.056L=56mL,故答案为:56;
Ⅲ.(1)根据电解装置可知,产生氧气的一极为电解池的阳极,根据异性相吸规律可知,氢离子向阴极移动,所以,氢离子的移动方向是从右向左;
(2)电解时,二氧化碳在b极上生成乙烯,得到电子的一极为电源的正极,电极反应式为:2CO2+12H++12e-=C2H4+4H2O,故答案为:2CO2+12H++12e-=C2H4+4H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】由H、C、N、O、S等元素形成多种化合物在生产生活中有着重要应用。
I.化工生产中用甲烷和水蒸气反应得到以CO和H2为主的混合气体,这种混合气体可用于生产甲醇,回答下列问题:
(1)对甲烷而言,有如下两个主要反应:
①CH4(g)+1/2O2(g)=CO(g)+2H2(g)△H1=-36kJ·mol-1
2CH4(g)+H2O(g)=CO(g)+3H2(g)△H2=+216kJ·mol-1
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H2,为维持热平衡,年生产lmolCO,转移电子的数目为______________________。
(2)甲醇催化脱氢可制得重要的化工产品一甲醛,制备过程中能量的转化关系如图所示。
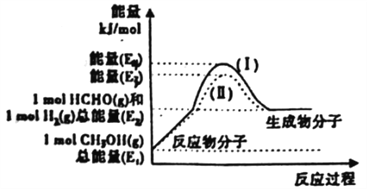
①写出上述反应的热化学方程式________________________________。
②反应热大小比较:过程I________过程II(填“大于”、“小于”或“等于”)。
II.(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领城的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,删得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低。其可能的原因为_____________________________________,
在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在_______K左右。
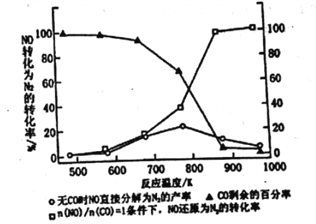
(4)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①写出NO与活性炭反应的化学方程式_________________________________________;
②若T1<T2
③上述反应T1℃时达到化学平衡后再通入0.1mol NO气体,则达到新化学平衡时NO的转化率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均是由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如图所示的关系。下列说法错误的是
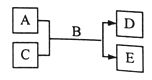
A.简单离子半径大小关系:Y>Z>X>WB.图示反应中有离子键的形成
C.简单阴离子的还原性:Y>ZD.D的水溶液中含有阴、阳离子及共价键形成的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积为 5L 的密闭容器中发生可逆反应:C(s)+H2O(g) ![]() CO(g)+H2(g)。
CO(g)+H2(g)。
(1)请写出该反应的化学平衡常数表达式 K= ________________________ 。
(2)不能判断该反应一定达到化学平衡状态的依据是_____________(填字母)
A.υ正(H2O)=υ逆(H2)
B.消耗 n mol H2 的同时消耗 n mol CO
C.容器中混合气体的密度不随时间而变化
D.混合气体的压强不再变化
(3)若在固定容积为 5L 的密闭容器中加入的是 2 mol Fe(s)与 1 mol H2O(g),发生反应: 3Fe(s)+4H2O(g) ![]() Fe3O4(s)+4H2(g),△H<0,t1 秒时,H2 的物质的量为 0.2 mol,到 t2 秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
Fe3O4(s)+4H2(g),△H<0,t1 秒时,H2 的物质的量为 0.2 mol,到 t2 秒时恰好达到平衡,此时 H2的物质的量为 0.35 mol。
①t1~t2这段时间内的反应速率υ(H2O)=____;达到平衡时,H2的体积分数为____。
②若继续加入 2 mol Fe(s),则平衡___________移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1molH2O再次达到平衡后,H2的物质的量为___________。
③该反应的逆反应速率随时间变化的关系如图:

t1时改变了某种条件,改变的条件可能是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.计算下列溶液的pH值(25 ℃),(请写出计算过程)将20mL0.01 mol·L-1 KOH溶液与30mL0.005mol·L-1H2SO4溶液混合并加水至100ml.
(1)求KOH溶液的pH值_______________;
(2)求H2SO4溶液的pH值_______________;
(3)求混合液的pH值_______________。
II.将10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH(酸)与强碱的pH(碱)之间应满足的关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 molL-1的W后会发生如下反应:2W(g)=M(g) △H =a kJ mol-1。其中M的物质的量浓度随时间的变化如图所示:

下列说法错误的是
A.从反应开始到刚达到平衡时间段内,υ(W) =0.02 molL-1s-1
B.a、b两时刻生成W的速率:υ(a)<υ(b)
C.用W浓度变化值表示的ab、bc两个时段内的反应速率:υ(ab)>υ(bc) =0
D.其他条件相同,起始时将0.2 mol L-1氦气与W混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(结构式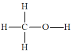 )是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)
)是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
(1)已知反应中的相关化学键键能数据如下:
化学键 | O-H | C-O | C=O |
E/(kJ | 465 | 343 | 750 |
甲醇中C-H键比氢气中H-H键____(填“强”或“弱”)。相同条件下该反应的正反应活化能Ea(正)=210 kJ·mol-1,则逆反应活化能Ea(逆)=______kJ·mol-1。
(2)在1 L恒容密闭容器中充入CO2和H2,所得实验数据如下表
实验编号 | 温度/。C | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO2) | n(H2) | n(CH3OH) | ||
① | 150 | 0.23 | 0.19 | 0.03 |
② | 200 | 0.10 | 0.26 | 0.02 |
③ | 200 | 0.17 | a | 0.01 |
实验①平衡常数K=______,若在该温度下起始时加入二氧化碳、氢气、甲醇气体和水蒸气各0.10 mol,这时反应向________移动(填“正反应方向”、“逆反应方向”或“不”),判断理由是______。
实验②达到平衡时H2转化率为____。
实验③a=_________。
(3)甲醇、空气和稀硫酸可以形成燃料电池,其正极电极反应式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com