
【题目】100℃时,向某恒容密闭容器中加入1.6 molL-1的W后会发生如下反应:2W(g)=M(g) △H =a kJ mol-1。其中M的物质的量浓度随时间的变化如图所示:

下列说法错误的是
A.从反应开始到刚达到平衡时间段内,υ(W) =0.02 molL-1s-1
B.a、b两时刻生成W的速率:υ(a)<υ(b)
C.用W浓度变化值表示的ab、bc两个时段内的反应速率:υ(ab)>υ(bc) =0
D.其他条件相同,起始时将0.2 mol L-1氦气与W混合,则反应达到平衡所需时间少于60 s
【答案】D
【解析】
A. 根据图中信息可知,从反应开始到刚达到平衡时间段内![]() =0.01 molL-1s-1,则
=0.01 molL-1s-1,则![]() =
=![]() =0.02 molL-1s-1,A项正确;
=0.02 molL-1s-1,A项正确;
B. 随着反应的进行,消耗的W的浓度越来越小,生成W的速率即逆反应速率越来越大,因此a、b两时刻生成W的速率:υ(a)<υ(b),B项正确;
C.随着反应的进行,W的消耗速率越来越小,直至保持不变,bc时段反应处于平衡状态,则用W浓度变化值表示的ab、bc两个时段内的反应速率为:υ(ab)>υ(bc) =0,C项正确;
D. 其他条件相同,起始时将0.2 mol L-1氦气与W混合,与原平衡相比,W所占的分压不变,则化学反应速率不变,反应达到平衡所需时间不变,D项错误;
答案选D。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作、解释或结论均正确的是
选项 | 实验目的 | 操作 | 结论或解释 |
A | 检验 | 取待测液少许,加入过量的 | 液体分层,加入硝酸酸化的 |
B | 检验某溶液中有无 | 取待测液少许,加入盐酸,有气体放出,将气体通入澄清石灰水中 | 澄清石灰水变浑浊,则含 |
C | 检验溶液中的 | 取待测液少许,先通入氯气,再加KSCN溶液 | 溶液变红色,则含 |
D | 检验食盐中是否含 | 取少量食盐溶于水,加少量淀粉 | 溶液变蓝色,则含 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烃在碱性醇溶液中能发生消去反应。
例如,![]()
该反应式也可表示为
下面是几种有机化合物的转化关系:

(1)根据系统命名法,化合物A的名称是_____________。
(2)反应①的反应类型_________,反应③的反应类型___________
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:_______。
(4)C2的结构简式是______________,F1的结构简式是______________,F1与F2互为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。(已知:A与金属钠可以反应生成无色气体)
![]()
(1)A物质所含官能团的名称是:_______,A与钠反应的化学方程式为_________。
(2)反应③的化学方程式是:________。
(3)下列物质中,不能通过乙烯加成反应得到的是:_______(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(4)葡萄可用于酿酒。检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2悬浊液,加热,其现象是:__。
(5)若D为一种常见的高分子化合物,可以用于制作保鲜膜,则反应①的反应类型为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种高分子化合物,常用作有机合成的中间体,并可用作乳胶漆等。可以通过以下途径合成:

已知有机物A中含有C、H、O、Cl四种元素且同一个碳原子上不直接连接两个官能团。
(1)A的结构简式为___________或___________;反应③的反应类型_____________________。
(2) 写出反应⑤和反应⑥的化学方程式:反应⑤___________;反应⑥(在一定条件下)___________。
(3)写出1种E的同系物的名称_____________________。写出1种与F含有相同官能团的F的同分异构体的结构简式_______________。
(4)试设计一条以![]() 为原料合成
为原料合成![]() 的合成路线__________________。(合成路线常用的表示方式为:甲
的合成路线__________________。(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色固体,熔点为390℃,沸点为430 ℃,溶于冷水,遇热水强烈水解,主要用于有机合成和药物制造。实验室制备少量氨基锂的装置如图所示(部分夹持装置已略):
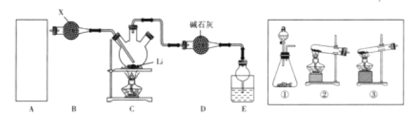
(1)A中装置是用于制备氨气的,若制备氨气的试剂之一是熟石灰,则A中制气装置是______(从方框中选用,填序号);用浓氨水与生石灰反应也可制取NH3,反应的化学方程式为_______。
(2)试剂X是_________,装置D的作用是_______。
(3)实验中需要先向C通入一段时间的NH3再点燃C处酒精灯,这样做的目的是____,可根据E中____(填现象)开始给锂加热。
(4)某同学经理论分析认为LiNH2遇热水时可生成一种气体,试设计一种方案检验该气体:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证与![]() 和
和![]() 的氧化性强弱,下列装置能达到实验目的的是____________________(填序号),写出正极的电极反应式___________________。若构建原电池时两个电极的质量相等,当导线中通过
的氧化性强弱,下列装置能达到实验目的的是____________________(填序号),写出正极的电极反应式___________________。若构建原电池时两个电极的质量相等,当导线中通过![]() 电子时,两个电极的质量差为____________________。
电子时,两个电极的质量差为____________________。

(2)将![]() 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
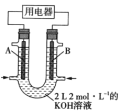
实验测得电池工作时![]() 向B电极定向移动,则____________________(填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________。
向B电极定向移动,则____________________(填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________。
(3)以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。燃料电池的结构如图所示:
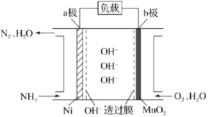
①a极是电池的____________________(填“正”或“负”)极,电极反应式为_______________________。
②当生成![]() 时,电路中通过的电子的物质的量为____________________。
时,电路中通过的电子的物质的量为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料。某探究小组利用下列反应和装置制备一硝基甲苯。
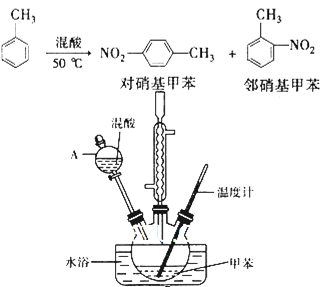
实验中可能用到的数据:
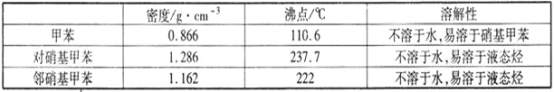
实验步骤:①按体积比1:3配制浓硫酸与浓硝酸混合物40 mL;
②在三颈瓶中加入15 mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10 min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60 g。
请回答下列问题:
(1)配制混酸的方法是________。反应中需不断搅拌,目的是______________
(2)仪器A的名称是________ ,使用该仪器前必须进行的操作是_________。
(3)若实验后在三颈瓶中收集到的产物较少,可能的原因是_________。
(4)分离反应后产物的方案如下:

其中,操作1的名称为________,操作2中需要使用下列仪器中的________(填序号)。
A.冷凝管 B.酒精灯 C.温度计 D.分液漏斗 E.蒸发皿
(5)该实验中一硝基甲苯的产率为________(保留两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com