
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。(已知:A与金属钠可以反应生成无色气体)
![]()
(1)A物质所含官能团的名称是:_______,A与钠反应的化学方程式为_________。
(2)反应③的化学方程式是:________。
(3)下列物质中,不能通过乙烯加成反应得到的是:_______(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(4)葡萄可用于酿酒。检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2悬浊液,加热,其现象是:__。
(5)若D为一种常见的高分子化合物,可以用于制作保鲜膜,则反应①的反应类型为:______。
【答案】羟基 2CH3CH2OH +2Na →2CH3CH2ONa + H2↑ 2CH3CH2OH + O2![]() 2CH3CHO + 2H2O b 产生砖红色沉淀 加聚反应
2CH3CHO + 2H2O b 产生砖红色沉淀 加聚反应
【解析】
由有机化合物合成路线图可知,A氧化成B,B氧化成乙酸,采用逆推法,则可判断B为乙醛,A为乙醇,D是高分子化合物,乙烯发生加聚反应生成D为![]() ,据此解答。
,据此解答。
(1)由上分析可知,A为乙醇,其结构简式为CH3CH2OH,可知含有的官能团是羟基,乙醇与Na反应,生成乙醇钠和氢气,反应方程式为2CH3CH2OH +2Na →2CH3CH2ONa + H2↑,答案为羟基,2CH3CH2OH +2Na →2CH3CH2ONa + H2↑。
(2)乙醇催化氧化生成乙醛的化学方程式为2CH3CH2OH + O2![]() 2CH3CHO + 2H2O,答案为2CH3CH2OH + O2
2CH3CHO + 2H2O,答案为2CH3CH2OH + O2![]() 2CH3CHO + 2H2O。
2CH3CHO + 2H2O。
(3)乙烯和氢气加成生成乙烷,和溴化氢发生加成生成溴乙烷,CH3CHCl2无法通过加成反应制得,答案为b。
(4)葡萄糖中含有醛基,能被新制的氢氧化铜悬浊液氧化,所以实验现象是产生砖红色沉淀氧化亚铜;答案为产生砖红色沉淀。
(5)工业上以乙烯为原料生产聚乙烯的化学方程式为nCH2=CH2![]()
![]() ,反应类型属于加聚反应;答案为加聚反应。
,反应类型属于加聚反应;答案为加聚反应。


科目:高中化学 来源: 题型:
【题目】处于相邻两个周期的主族元素A、B、C、D,它们的原子半径依次变小;A离子和B离子的电子层相差两层,且能形成BA2型的离子化合物;C的离子带3个正电荷且核外电子排布与氖相同;D气态氢化物的分子式为H2D,D在它的最高价氧化物中的质量分数是40%且D原子核中有16个中子。
试回答:
(1)按要求填空:
A元素的名称______________;B元素的符号____________;
C原子的外围电子排布式为____________;D的原子结构示意图____________;
(2)B、C、D的第一电离能由大到小的顺序是:______________(填元素符号);
(3)A、B、C的电负性由大到小的顺序是:____________(填元素符号);
(4)A与B形成的化合物的电子式__________________;
(5)将C投入到的KOH溶液中现象为______________,相应的离子反应方程式为________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮的循环和转化对生产、生活有重要的价值。
I.(1)写出实验室制备氨气的化学方程式________ 。
II.氨是重要的化工原料。某工厂用氨制硝酸和铵盐的流程如下图所示。
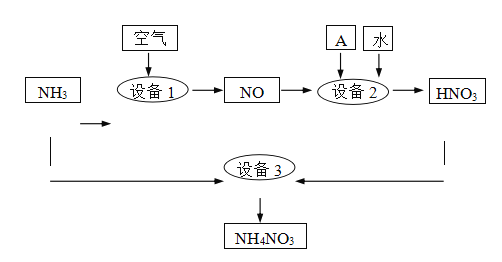
(2)设备1、3中发生反应的化学方程式分别是______、 ________ 。设备2中通入的物质A是________。
III.氨氮废水的去除是当前科学研究的热点问题。氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在。某工厂处理氨氮废水的流程如下:
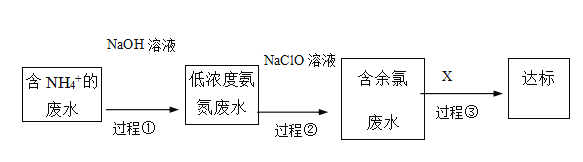
(3)过程①的目的是将NH4+转化为NH3,并通过鼓入大量空气将氨气吹出,写出NH4+转化为NH3的离子方程式________ 。
(4)过程②加入NaClO溶液可将氨氮转化为无毒物质,反应后含氮元素、氯元素的物质化学式分别为___、_______。
(5)含余氯废水的主要成分是NaClO以及HClO,X可选用以下哪种溶液以达到去除余氯的目的(填序号)_________。
a.KOH b.Na2SO3 c.KMnO4 D.NaCl
写出其中一个反应的离子方程式__________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)写出①、②两种元素的名称:______、______。
(2)写出⑧、⑨两种元素的符号______、______。
(3)在这些元素中,最活泼的金属元素的离子结构示意图是______最活泼的非金属元素是____(填元素符号,下同),______是最不活泼的元素。
(4)这些元素的最高价氧化物对应水化物中, _____(填化学式,下同)酸性最强, _____碱性最强;能形成两性氢氧化物的元素是______(填元素符号)。
(5)在⑤到![]() 的元素中, _____(填元素符号)原子半径最小。
的元素中, _____(填元素符号)原子半径最小。
(6)比较⑤和⑥的化学性质, _____(填元素符号)更活泼,试用实验证明之(简述操作、现象和结论)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列微粒:① 16O ② 35Cl2 ③ 18O ④ 14N ⑤ 14C ⑥ H ⑦ D ⑧ 37Cl2
(1)互为同位素的是:_______;(填序号,下同)中子数相等的是:_______
(2)同位素原子可以用作“示踪原子”,研究一些反应机理。
①已知可逆反应2SO2+O2![]() 2SO3 ,向一密闭容器内充入SO2和18O2,反应一段时间后,18O可能存在于_______
2SO3 ,向一密闭容器内充入SO2和18O2,反应一段时间后,18O可能存在于_______
A. 仅O2中 B. 仅SO3中 C. 仅O2和SO3中 D. O2 、 SO2 、SO3中
②根据乙酸和乙醇发生反应的原理,写出CH3CO18OH与CH3CH2OH反应的化学方程式:_______。
(3)20g D2O中质子的物质的量为:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.苯乙烯分子中所有原子可能共平面
B.苯、乙酸、乙醇均能发生取代反应
C.分子式为![]() 的同分异构体共有5种(不考虑立体异构)
的同分异构体共有5种(不考虑立体异构)
D.可用溴的四氯化碳溶液区分![]() 和
和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 molL-1的W后会发生如下反应:2W(g)=M(g) △H =a kJ mol-1。其中M的物质的量浓度随时间的变化如图所示:

下列说法错误的是
A.从反应开始到刚达到平衡时间段内,υ(W) =0.02 molL-1s-1
B.a、b两时刻生成W的速率:υ(a)<υ(b)
C.用W浓度变化值表示的ab、bc两个时段内的反应速率:υ(ab)>υ(bc) =0
D.其他条件相同,起始时将0.2 mol L-1氦气与W混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①若![]() 和
和![]() 的电子层结构相同,则原子序数:
的电子层结构相同,则原子序数:![]()
②![]() 、
、![]() 、
、![]() 、
、![]() 熔点随相对分子质量增大而升高
熔点随相对分子质量增大而升高
③![]() 、
、![]() 、
、![]() 、
、![]() 分子中所有原子都满足8电子结构
分子中所有原子都满足8电子结构
④干冰升华不会破坏共价键
⑤![]() 分子很稳定是由于
分子很稳定是由于![]() 分子之间能形成氢键
分子之间能形成氢键
A.②④B.①②④C.②④⑤D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能是由![]() 、Fe、
、Fe、![]() 、
、![]() 中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)
中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)
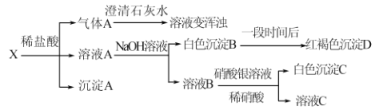
下列说法不正确的是
A.气体A是![]() 、
、![]() 的混合物
的混合物
B.沉淀A是![]()
C.根据白色沉淀C是AgCl可知,白色沉淀B一定不是纯净物
D.该固体混合物一定含有Fe、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com