
【题目】下列说法正确的是( )
①若![]() 和
和![]() 的电子层结构相同,则原子序数:
的电子层结构相同,则原子序数:![]()
②![]() 、
、![]() 、
、![]() 、
、![]() 熔点随相对分子质量增大而升高
熔点随相对分子质量增大而升高
③![]() 、
、![]() 、
、![]() 、
、![]() 分子中所有原子都满足8电子结构
分子中所有原子都满足8电子结构
④干冰升华不会破坏共价键
⑤![]() 分子很稳定是由于
分子很稳定是由于![]() 分子之间能形成氢键
分子之间能形成氢键
A.②④B.①②④C.②④⑤D.③④⑤
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:

①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:

烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平。以乙烯为主要原料合成重要的有机化合物路线如下图所示,请回答下列问题。(已知:A与金属钠可以反应生成无色气体)
![]()
(1)A物质所含官能团的名称是:_______,A与钠反应的化学方程式为_________。
(2)反应③的化学方程式是:________。
(3)下列物质中,不能通过乙烯加成反应得到的是:_______(填序号)。
a. CH3CH3 b. CH3CHCl2 c. CH3CH2Br
(4)葡萄可用于酿酒。检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2悬浊液,加热,其现象是:__。
(5)若D为一种常见的高分子化合物,可以用于制作保鲜膜,则反应①的反应类型为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基锂(LiNH2)是一种白色固体,熔点为390℃,沸点为430 ℃,溶于冷水,遇热水强烈水解,主要用于有机合成和药物制造。实验室制备少量氨基锂的装置如图所示(部分夹持装置已略):
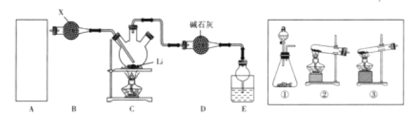
(1)A中装置是用于制备氨气的,若制备氨气的试剂之一是熟石灰,则A中制气装置是______(从方框中选用,填序号);用浓氨水与生石灰反应也可制取NH3,反应的化学方程式为_______。
(2)试剂X是_________,装置D的作用是_______。
(3)实验中需要先向C通入一段时间的NH3再点燃C处酒精灯,这样做的目的是____,可根据E中____(填现象)开始给锂加热。
(4)某同学经理论分析认为LiNH2遇热水时可生成一种气体,试设计一种方案检验该气体:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的 SO2气体和 SO3气体相比较,正确的说法是
A. 密度比为 4:5 B. 物质的量之比为 4:5
C. 体积比为 1:1 D. 原子数之比为 3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为100的有机物A能与钠反应,且完全燃烧只生成CO2和H2O。若A含一个六碳环,则环上一氯代物的数目为( )
A. 5B. 4C. 3D. 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证与![]() 和
和![]() 的氧化性强弱,下列装置能达到实验目的的是____________________(填序号),写出正极的电极反应式___________________。若构建原电池时两个电极的质量相等,当导线中通过
的氧化性强弱,下列装置能达到实验目的的是____________________(填序号),写出正极的电极反应式___________________。若构建原电池时两个电极的质量相等,当导线中通过![]() 电子时,两个电极的质量差为____________________。
电子时,两个电极的质量差为____________________。

(2)将![]() 设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
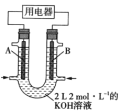
实验测得电池工作时![]() 向B电极定向移动,则____________________(填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________。
向B电极定向移动,则____________________(填“A”或“B”)处电极入口通甲烷,其电极反应式为_____________。
(3)以氨作为燃料的燃料电池,具有能量效率高的特点,另外氨气含氢量高,易液化,方便运输和贮存,是很好的氢源载体。燃料电池的结构如图所示:
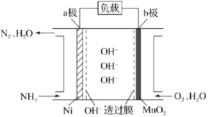
①a极是电池的____________________(填“正”或“负”)极,电极反应式为_______________________。
②当生成![]() 时,电路中通过的电子的物质的量为____________________。
时,电路中通过的电子的物质的量为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某混合物A,含有KAl(SO4)2、Al2O3和Cu2(OH)2CO3,在一定条件下可实现下图所示的物质之间的变化:
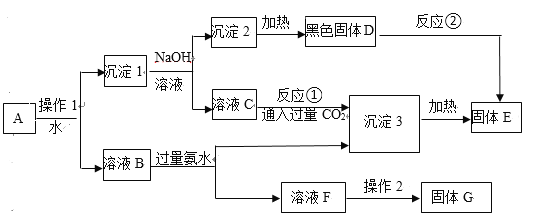
据此判断:
(1)固体G中含有用作化肥的物质,写出其化学式_________。
(2)出土的青铜器上常有铜绿,请写出用稀硫酸除去铜绿的离子方程式_________。
(3)操作1的名称____________; 反应①的离子方程式为____________。
(4)反应②的化学方程式为______________。
II.铝是一种应用广泛的金属,工业上常用冰晶石(Na3AlF6)作助熔剂来冶炼铝。以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
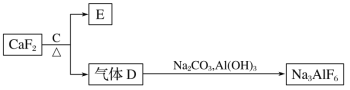
(5)E在医疗上常用作石膏绷带,D的水溶液可用于刻蚀玻璃,C的化学式为_____;并写出由D制备冰晶石的化学方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年7月5日《科学》杂志在线报道:合成一种新的具有超高热导率半导体材料——砷化硼(BAs)。通过反应4BI3(g) + As4(g)![]() 4BAs(s,晶体) + 6I2(g)可制备BAs晶体。下列说法错误的是()
4BAs(s,晶体) + 6I2(g)可制备BAs晶体。下列说法错误的是()
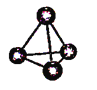
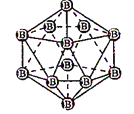
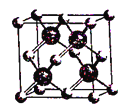
图(a) 图(b) 图(c)
A. 图(a)表示As4结构,As4分子中成键电子对与孤电子对数目之比为3:1
B. 图(b)表示晶态单质硼的B12基本结构单元,该基本单元为正20面体
C. 图(b)所示晶态单质硼的熔点为2180℃,它属于原子晶体
D. 图(c)表示BAs晶胞结构,As原子的配位数为4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com