
【题目】甲醇(结构式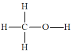 )是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)
)是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
(1)已知反应中的相关化学键键能数据如下:
化学键 | O-H | C-O | C=O |
E/(kJ | 465 | 343 | 750 |
甲醇中C-H键比氢气中H-H键____(填“强”或“弱”)。相同条件下该反应的正反应活化能Ea(正)=210 kJ·mol-1,则逆反应活化能Ea(逆)=______kJ·mol-1。
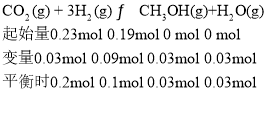
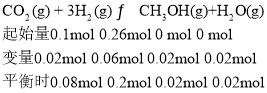
(2)在1 L恒容密闭容器中充入CO2和H2,所得实验数据如下表
实验编号 | 温度/。C | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO2) | n(H2) | n(CH3OH) | ||
① | 150 | 0.23 | 0.19 | 0.03 |
② | 200 | 0.10 | 0.26 | 0.02 |
③ | 200 | 0.17 | a | 0.01 |
实验①平衡常数K=______,若在该温度下起始时加入二氧化碳、氢气、甲醇气体和水蒸气各0.10 mol,这时反应向________移动(填“正反应方向”、“逆反应方向”或“不”),判断理由是______。
实验②达到平衡时H2转化率为____。
实验③a=_________。
(3)甲醇、空气和稀硫酸可以形成燃料电池,其正极电极反应式为________。
【答案】弱 259 4.5 逆反应方向 Q=![]() 23.08% 0.13
23.08% 0.13 ![]()
【解析】
(1)根据△H=反应的总键能-生成物的总键能,有△H=(2×750+3EH-H)kJ·mol-1-(3EC-H×2+465×3)kJ·mol-1=-49kJ·mol-1,则EH-H-EC-H=63kJ·mol-1>0,因此甲醇中C-H键比氢气中H-H键弱;
根据△H=正反应活化能-逆反应的活化能=Ea(正)-Ea(逆)=-49kJ·mol-1,解得Ea(逆)=259KJ/mol;
(2)利用三等式求平衡常数,有
则实验①的平衡常数![]() ;
;
若在该温度下起始时加入二氧化碳、氢气、甲醇气体和水蒸气各0.10mol,此时的浓度商![]() ,则此时反应向逆反应方向移动;
,则此时反应向逆反应方向移动;
实验②,开始投入H2的物质的量为0.26mol,达到平衡时得到0.02molCH3OH,根据化学方程式,需要消耗0.06molH2,则氢气的转化率达到平衡时H2的转化率,有![]() ;
;
实验③和实验②所处温度相同,平衡常数相同,利用平衡常数相同,求a的值,利用三等式和实验②,求出该温度下的平衡常数,有
则实验③的三等式,有
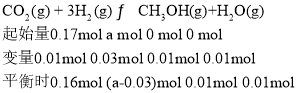 ;
;
因温度相同,则平衡常数相等![]()
解得a=0.13;
(3)甲醇、空气和稀硫酸可以形成燃料电池,正极得电子,发生还原反应,则正极反应式为O2+4e-+4H+=2H2O。


科目:高中化学 来源: 题型:
【题目】![]() 是燃烧和代谢的最终产物,也是造成温室效应的废气,但
是燃烧和代谢的最终产物,也是造成温室效应的废气,但![]() 作为一种资源,开发和利用的前景十分诱人.
作为一种资源,开发和利用的前景十分诱人.
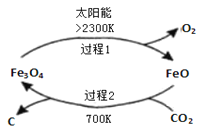
I、利用太阳能,以![]() 为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
为原料制取炭黑的流程如图所示.过程2的化学方程式为______.
II、近年科学家提出“绿色自由”构想.把含有大量![]() 的空气吹入
的空气吹入![]() 溶液中,再把
溶液中,再把![]() 从溶液中提取出来,并使之与
从溶液中提取出来,并使之与![]() 反应生成.其工艺流程如图所示:
反应生成.其工艺流程如图所示:

![]() 由吸收池导入分解池中的主要物质的化学式是______.
由吸收池导入分解池中的主要物质的化学式是______.
![]() 上述流程中______
上述流程中______![]() 填化学式
填化学式![]() 可循环使用,体现了该流程的“绿色”.
可循环使用,体现了该流程的“绿色”.
![]() 不同温度下,在1L恒容密闭容器中充入2mol
不同温度下,在1L恒容密闭容器中充入2mol![]() 和5mol
和5mol![]() ,相同时间内测得
,相同时间内测得![]() 的转化率随温度变化如图所示:
的转化率随温度变化如图所示:

![]() 合成塔中发生的化学反应方程式为______.
合成塔中发生的化学反应方程式为______.
![]() 时a点(正)______ (逆)(填“
时a点(正)______ (逆)(填“![]() ”,“
”,“![]() ”,“
”,“![]() ”);
”);
![]() 计算温度为
计算温度为![]() 时b的平衡常数为______.
时b的平衡常数为______.
![]() 为检验吸收池中饱和
为检验吸收池中饱和![]() 溶液是否充足,量取100mL吸收液用
溶液是否充足,量取100mL吸收液用![]() 盐酸滴定,生成的
盐酸滴定,生成的![]() 标准状况下
标准状况下![]() 随
随![]() 盐酸
盐酸![]() 变化关系如图所示:
变化关系如图所示:

则该100mL吸收液还可吸收标准状况下______![]() .
.
Ⅲ![]() 以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将
以稀硫酸为电解质溶液,惰性材料为电极,利用太阳能将![]() 转化为低碳烯烃,工作原理如图所示.
转化为低碳烯烃,工作原理如图所示.

![]() 的移动方向是______
的移动方向是______![]() 填从左至右或从右至左
填从左至右或从右至左![]()
![]() 产生乙烯的电极反应式为______.
产生乙烯的电极反应式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为2L的密闭容器中,3molX和3molY发生反应:3X(g)+Y(g)![]() 2Z(g) ΔH>0,经60s达到平衡,生成0.4molZ。下列说法正确的是( )
2Z(g) ΔH>0,经60s达到平衡,生成0.4molZ。下列说法正确的是( )
A.60s内平均反应速率v(X)=0.05mol/(L·s)
B.其他条件不变,升高温度,正反应速率增大,逆反应速率减小
C.其他条件不变,若初始投入2molX和2molY,则物质Y的转化率减小
D.其他条件不变,将容器体积变为4L,Z的平衡浓度变为原来的一半
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然的和绝大部分人工制备的晶体都存在各种缺陷,例如,某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,则该晶体中Ni3+与Ni2+的离子数之比为( )
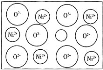
A.6:85B.6:91C.5:91D.5:85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3-CH=CH2+HBr![]() CH3-CHBr-CH3主要产物
CH3-CHBr-CH3主要产物![]() 。1mol烃A充分燃烧后可以得到
。1mol烃A充分燃烧后可以得到![]() 和
和![]() 。烃A在不同条件下能发生如下图所示的一系列变化。
。烃A在不同条件下能发生如下图所示的一系列变化。
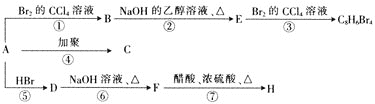
(1)A的结构简式为______。
(2)上述反应中,①是________反应,⑦是________反应。![]() 填反应类型
填反应类型![]()
(3)写出C、H的结构简式:C______________H____________
(4)写出反应D→F的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。8gN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=+267kJ·mol-1
N2(g)+H2O(g) ΔH=+267kJ·mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=+534kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-133.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

| 苯 | 溴 | 溴苯 |
密度 | | | |
沸点 | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入![]() 液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、![]() 的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是___![]() 填入正确选项前的字母
填入正确选项前的字母![]() ;
;
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是________。
a.25 mL ![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室里制取氨气的是( )
A.加热试管中的氯化铵固体
B.将烧瓶中的浓氨水加热
C.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。
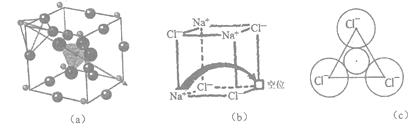
根据所学知识回答下列问题:
(1)在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的________能级,此过程会________ (填“吸收”或“释放”)能量。
(2)BF4-中B的杂化形式为________________,其等电子体为___________(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是___________。
(3)图(a)所示晶胞中Li+位于_____位置;若将晶体中BF4-换成F-,导电能力会明显降低,原因是______________________________。
(4)图(6)中,若缺陷处填充了Na+,则它__________(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的__________面体空隙中。
(5)有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。__________。(已知:![]() ≈1.414,
≈1.414,![]() ≈1.732)
≈1.732)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com