
【题目】下列方法中,不能用于实验室里制取氨气的是( )
A.加热试管中的氯化铵固体
B.将烧瓶中的浓氨水加热
C.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
【答案】A
【解析】
A. 氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气,A错误;
B. 氨水中存在平衡关系:NH3+H2O![]() NH3·H2O
NH3·H2O![]() +OH-,加热浓氨水,氨气溶解度降低,从溶液中逸出,平衡向逆反应方向移动,可以制取氨气,B正确;
+OH-,加热浓氨水,氨气溶解度降低,从溶液中逸出,平衡向逆反应方向移动,可以制取氨气,B正确;
C. 利用CaO与H2O剧烈反应,生成Ca(OH)2,放出大量热,促进NH3·H2O的分解及NH3的挥发逸出,又由于Ca(OH)2是强碱,也促进NH3·H2O的分解及NH3的挥发逸出,反应的化学方程式为:NH3·H2O+CaO═NH3↑+Ca(OH)2,C正确;
D. 熟石灰和氯化铵混合,加水调成泥状后加热可以制取氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,D正确;故答案为:A。
CaCl2+2NH3↑+2H2O,D正确;故答案为:A。


科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(结构式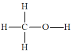 )是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)
)是一种基础有机化工原料,应用广泛。工业上可利用废气中的CO2合成CH3OH,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
CH3OH(g)+H2O(g) △H=-49 kJ·mol-1。
(1)已知反应中的相关化学键键能数据如下:
化学键 | O-H | C-O | C=O |
E/(kJ | 465 | 343 | 750 |
甲醇中C-H键比氢气中H-H键____(填“强”或“弱”)。相同条件下该反应的正反应活化能Ea(正)=210 kJ·mol-1,则逆反应活化能Ea(逆)=______kJ·mol-1。
(2)在1 L恒容密闭容器中充入CO2和H2,所得实验数据如下表
实验编号 | 温度/。C | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO2) | n(H2) | n(CH3OH) | ||
① | 150 | 0.23 | 0.19 | 0.03 |
② | 200 | 0.10 | 0.26 | 0.02 |
③ | 200 | 0.17 | a | 0.01 |
实验①平衡常数K=______,若在该温度下起始时加入二氧化碳、氢气、甲醇气体和水蒸气各0.10 mol,这时反应向________移动(填“正反应方向”、“逆反应方向”或“不”),判断理由是______。
实验②达到平衡时H2转化率为____。
实验③a=_________。
(3)甲醇、空气和稀硫酸可以形成燃料电池,其正极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )

A.图中T1<T2
B.M区域内任意点均有c(H+)<c(OH-)
C.两条曲线间任意点均有c(H+)·c(OH-)=Kw
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的叙述,正确的是( )
A. 与
与 互为同分异构体
互为同分异构体
B.O2和O3互为同位素
C.苯乙烯(![]() )所有原子一定在同一平面上
)所有原子一定在同一平面上
D.H2O和D2O化学性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Co、Ni的化合物在生产生活中有着广泛的应用。
(1)Co元素在周期表中的位置是4周期________族。基态Co原子的简化电子排布式为_________。
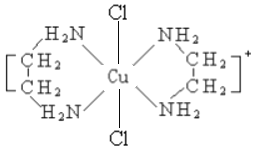
(2)乙二胺NH2-CH2-CH2-NH2(缩写符号en)中N原子的杂化方式为________杂化。en可以与Co形成配合物[Co(en)2Cl2]Cl·HCl·2H2O,配离子结构如下左图所示,中心离子的配位数为_______,配合物晶体中可能存在的作用力有___________。
A 离子键 B 极性共价键 C 非极性共价键 D 配位键 E 氢键
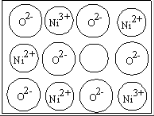
(3)天然氧化镍晶体中总是存在晶体缺陷,如图所示。NiXO晶体中x值为![]() ,若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为______。
,若晶体中的Ni分别为Ni2+、Ni3+,此晶体中Ni2+与Ni3+的最简整数比为______。
(4)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列, Ni2+填充其中(如图),己知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为_____g(用a、NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 据Ksp(AgCl)=1.77×10﹣10,Ksp(Ag2CrO4)=2.0×10﹣12,可推知AgCl溶解度比Ag2CrO4的溶解度大
B. 处理水垢时常常先用碳酸钠溶液浸泡,再用酸溶解
C. 向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的大
D. AgCl在10 mL 0.1 mol/L的KCl溶液中溶解的质量比在10 mL0.05mol/L的AgNO3溶液中多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜是制备其他含铜化合物的重要原料。有以下三种制备硫酸铜的途径,下列说法
不正确的是
途径①:Cu![]() CuSO4
CuSO4
途径②:Cu![]() CuSO4
CuSO4
途径③:Cu![]() CuSO4
CuSO4
A.途径①中浓硫酸体现强氧化性和酸性
B.途径①中,100g98%的浓H2SO4与足量铜反应,可得到80gCuSO4
C.途径②所用混酸中硝酸与硫酸物质的量之比最好为2:3
D.相对于途径①和途径②,途径③更好的体现了绿色化学的思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)![]() C(g)+D(g),过程中的能量变化如图所示,回答下列问题。
C(g)+D(g),过程中的能量变化如图所示,回答下列问题。

(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________ kJ·mol-1(用含E1,E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”“减小”或“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com