
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )

A.图中T1<T2
B.M区域内任意点均有c(H+)<c(OH-)
C.两条曲线间任意点均有c(H+)·c(OH-)=Kw
D.XZ线上任意点均有pH=7
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。
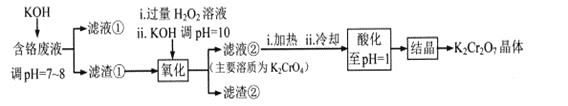
已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)滤渣②的主要成分为___________(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式_______________。
(3)“加热”操作的目的是__________________。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-1 (NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为 9.00 mL,则产品的纯度为_____________。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然的和绝大部分人工制备的晶体都存在各种缺陷,例如,某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,则该晶体中Ni3+与Ni2+的离子数之比为( )
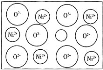
A.6:85B.6:91C.5:91D.5:85
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。8gN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。则下列热化学方程式中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(g) ΔH=+267kJ·mol-1
N2(g)+H2O(g) ΔH=+267kJ·mol-1
B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534kJ·mol-1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=+534kJ·mol-1
D.N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-133.5kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

| 苯 | 溴 | 溴苯 |
密度 | | | |
沸点 | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入![]() 液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了________气体。继续滴加至液溴滴完。装置d的作用是________________________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、![]() 的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_____;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是______;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是___![]() 填入正确选项前的字母
填入正确选项前的字母![]() ;
;
a.重结晶 b.过滤 c.蒸馏 d.萃取
(4)在该实验中,a的容积最适合的是________。
a.25 mL ![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐(已知:25℃,Ka(CH3COOH)=1.69×10-5)。
(1)醋酸钠溶液呈碱性的原因是___(写出有关的离子方程式);
(2)在CH3COONa溶液中离子浓度由大到小的顺序为___(用c(Bn+)表示相应离子浓度);
(3)对于醋酸溶液和醋酸钠溶液的下列说法正确的是___;
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小
B.升高温度可以促进醋酸电离,也可以促进醋酸钠水解
C.醋酸和醋酸钠混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离
D.醋酸和醋酸钠混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离
(4)物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是___;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
(5)常温时,有以下3种溶液,其中pH最小的是___;
A.0.02molL1CH3COOH与0.02molL1NaOH溶液等体积混合液
B.0.01molL1CH3COOH与0.03molL1NaOH溶液等体积混合液
C.pH=2的CH3COOH与pH=12的NaOH溶液等体积混合液
(6)用pH试纸在常温下分别测定0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸钠溶液,则pH(CH3COONa)__pH(Na2CO3)。(填:“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法中,不能用于实验室里制取氨气的是( )
A.加热试管中的氯化铵固体
B.将烧瓶中的浓氨水加热
C.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D.在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离子浓度/mol·L-1 | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;实验过程中,假设溶液体积不变。Ksp[CaCO3]=4.96×10-9,Ksp[MgCO3]=6.82×10-6,Ksp[Ca(OH)2]=4.68×10-6,Ksp[Mg(OH)2]=5.61×10-12。下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+,不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬镍基合金的性质稳定,抗高温燃气腐蚀能力强,广泛应用于舰船和工业的燃气轮机。某种铬镍基合金由Fe、Cr、Ni、C四种元素组成。
(1)Fe、Cr、Ni的基态原子核外电子占据的最高能层为________(填符号)。
(2)基态Cr原子价层电子的电子排布式为________,与Cr同周期且基态原子最外层电子数相同的元素,位于周期表的________区。
(3)Fe3+与SCN-反应生成红色的K3Fe(SCN)6,K3Fe(SCN)6内部的作用力有________。写出一种与SCN-互为等电子体的分子的化学式________。
(4)已知FeO、NiO的晶体结构均为NaCl型,且NiO的熔点高于FeO,其理由是________。
(5)由于晶体缺陷,Ni的某种氧化物的化学式为Ni0.88O,则该晶体中Ni2+和Ni3+最简整数比为________。
(6)C60分子结构及其晶胞结构如图1和图2所示。若在C60晶体的空隙中插入K+,该晶体在一定条件下具有超导能力,其结构如图3所示。

①C60分子中碳原子的杂化方式为________。
②该超导体晶胞中,K+填充在由C60围成的________空隙和________空隙中。
③若晶胞中A的坐标参数为(0,0,0),B的坐标为(1,1,1),则与A距离最近的K+的坐标参数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com