
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。
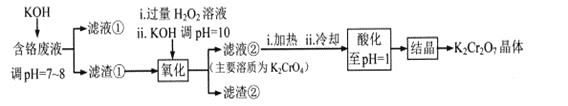
已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:

回答下列问题:
(1)滤渣②的主要成分为___________(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式_______________。
(3)“加热”操作的目的是__________________。
(4)“酸化”过程中发生反应2CrO42-+2H+![]() Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-1 (NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为 9.00 mL,则产品的纯度为_____________。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
【答案】Fe(OH)3 2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O 分解除去过量的H2O2 2×10-8mol/L 88.2%
【解析】
含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程:废液与足量KOH反应生成沉淀Cr(OH)3、Fe(OH)3,过滤得到滤渣①中含有Cr(OH)3、Fe(OH)3,除去K+、SO42-等离子,碱性条件下在滤渣中加入过氧化氢氧化Cr(OH)3生成K2CrO4,过滤除去Fe(OH)3,得到K2CrO4滤液②,加热除去过量过氧化氢,防止后续加酸时H2O2能将Cr2O72-还原为Cr3+,加酸调pH=1,使K2CrO4溶液转化为K2Cr2O7溶液,蒸发结晶得到K2Cr2O7晶体,据此分析解答。
(1)根据上述分析,滤渣①成分为Cr(OH)3、Fe(OH)3混合物,“氧化”步骤中Cr(OH)3转化为K2CrO4溶液,Fe(OH)3不反应也不溶与水,过滤分离的滤渣②为Fe(OH)3,故答案为:Fe(OH)3;
(2)“氧化”步骤中,碱性条件下,过氧化氢氧化Cr(OH)3生成K2CrO4溶液,结合电子守恒、原子守恒,反应的化学方程式为2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O,故答案为:2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O;
(3)因为在酸性条件下,H2O2能将Cr2O72-还原为Cr3+,为防止后续“酸化”步骤中H2O2将Cr2O72-还原为Cr3+而混入杂质,所以酸化之前必须除去H2O2,并且H2O2对热不稳定、易分解,可以通过加热除去,故答案为:除去过量的H2O2;
(4)酸化”过程中pH=1,即c(H+)=0.1mol/L,溶液中存在平衡2CrO42-+2H+Cr2O72-+H2O,平衡常数K=![]() =
=![]() =4×1014,解得:c(CrO42-)=2×10-8molL-1,故答案为:2×10-8molL-1;
=4×1014,解得:c(CrO42-)=2×10-8molL-1,故答案为:2×10-8molL-1;
(5)由反应K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4+Cr(SO4)3+6(NH4)2Fe(SO4)2+3Fe(SO4)3+ 7H2O有n(K2Cr2O7)=![]() n[(NH4)2Fe(SO4)2]=
n[(NH4)2Fe(SO4)2]=![]() ×0.0100mol/L×0.9L=0.0015mol,产品的纯度=
×0.0100mol/L×0.9L=0.0015mol,产品的纯度=![]() =
=![]() =88.2%,故答案为:88.2%。
=88.2%,故答案为:88.2%。


科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均是由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如图所示的关系。下列说法错误的是
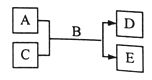
A.简单离子半径大小关系:Y>Z>X>WB.图示反应中有离子键的形成
C.简单阴离子的还原性:Y>ZD.D的水溶液中含有阴、阳离子及共价键形成的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.计算下列溶液的pH值(25 ℃),(请写出计算过程)将20mL0.01 mol·L-1 KOH溶液与30mL0.005mol·L-1H2SO4溶液混合并加水至100ml.
(1)求KOH溶液的pH值_______________;
(2)求H2SO4溶液的pH值_______________;
(3)求混合液的pH值_______________。
II.将10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH(酸)与强碱的pH(碱)之间应满足的关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,向某恒容密闭容器中加入1.6 molL-1的W后会发生如下反应:2W(g)=M(g) △H =a kJ mol-1。其中M的物质的量浓度随时间的变化如图所示:

下列说法错误的是
A.从反应开始到刚达到平衡时间段内,υ(W) =0.02 molL-1s-1
B.a、b两时刻生成W的速率:υ(a)<υ(b)
C.用W浓度变化值表示的ab、bc两个时段内的反应速率:υ(ab)>υ(bc) =0
D.其他条件相同,起始时将0.2 mol L-1氦气与W混合,则反应达到平衡所需时间少于60 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池是一种新型电池.其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。我国某研究小组新开发的一种流动电池如图所示.下列说法不正确的是( )

A.电子由b极流出,经导线流向a极
B.该电池工作时,H+移向a极得电子
C.b极的电极反应为Cu-2e-═Cu2+
D.该电池工作一段时间后,需要补充H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是( )

A.图中T1<T2
B.M区域内任意点均有c(H+)<c(OH-)
C.两条曲线间任意点均有c(H+)·c(OH-)=Kw
D.XZ线上任意点均有pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com