
科目: 来源: 题型:
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
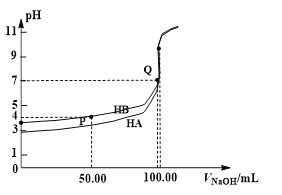
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】制备锌印刷电路板是用稀硝酸腐蚀锌板产生的废液称“烂板液”。“烂板液”中除含硝酸锌外,还含有自来水带入的Cl-和Fe3+,在实验室里,用“烂板液”制取ZnSO47HO的过程如图所示:

(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是___。
(2)若步骤①的pH>12,则Zn(OH) 2溶解生成偏锌酸钠(Na2ZnO2),Zn(OH) 2溶解的离子方程式为___。
(3)滤液D中除了含有OH-离子外,还含有的阴离子有___(填离子符号)。
(4)25℃时,若滤液E的pH=4,c(Zn2+)=2mol·L1,(Fe3+)=2.6×10-9mo·L1试求出Fe(OH)3的溶度积常数___(只写结果)。
(5)已知:①Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq) H=a kJ mol·L1
Fe3+(aq)+3OH-(aq) H=a kJ mol·L1
②H2O(l)![]() H+(aq)+OH-(aq) H=bkJ·mol·L1
H+(aq)+OH-(aq) H=bkJ·mol·L1
请写出Fe3+发生水解反应的热化学方程式:___。
若①的溶度积常数为Ksp,②的离子积常数为Kw,Fe3+发生水解反应的平衡常数:K=___(用含Kw、Ksp的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是![]() 的43倍,其分子式为______。
的43倍,其分子式为______。
(2)![]() 烷烃E完全燃烧,消耗标准状况下的
烷烃E完全燃烧,消耗标准状况下的![]()
![]() ,其分子式为______。
,其分子式为______。
(3)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为______。
(4)某有机物的结构表达式为![]() ,其名称是______。
,其名称是______。
(5)萘的结构式为![]() ,其分子式为______。
,其分子式为______。
(6)立方烷![]() 的六氯代物有______种。
的六氯代物有______种。
查看答案和解析>>
科目: 来源: 题型:
【题目】常稳下,某绝热容器中盛有50mLc(H+)=10-3mol·L-1的HX溶液,向该容器中滴加c(OH-)=10-2mol·L-1的NaOH溶液,滴加过程中混合溶波的温度(T)与所加溶液体积(V)的关系如图所示。下列叙述不正确的是
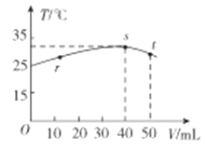
A.s点时:c(Na+)>c(X-)>c(OH-)>c(H+)
B.r→s的过程中,混合溶液中可能存在c(X-)=c(Na+)
C.pH=10的NaX溶液,用蒸馏水稀释10倍后,溶液的pH>9
D.已知某温度下CaX2的Ksp=5.3×10-9mol·L-3,在该温度下c(X-)=0.1mol·L-1的溶液中Ca2+可能的最高浓度是5.3×10-8mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL某一元酸(HA)溶液中逐滴加入0.1mol·L-1的NaOH溶液,测得混合溶液中由水电离出的c(H+)随加入NaOH溶液的体积变化关系图如下。下列说法不正确的是

A. Ka(HA)的数量级为10-5
B. d点溶液的pH最大
C. b点溶液显酸性,c(A-)>c(Na+)>c(H+)>c(OH-)
D. d点溶液中,c(Na+)+c(H+)=c(A-)+c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】天然的和绝大部分人工制备的晶体都存在各种缺陷,例如,某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代,结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成为Ni0.97O,则该晶体中Ni3+与Ni2+的离子数之比为( )
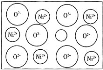
A.6:85B.6:91C.5:91D.5:85
查看答案和解析>>
科目: 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目: 来源: 题型:
【题目】已知![]() 在水中的电离方程式为:
在水中的电离方程式为:![]() 。某温度下,向
。某温度下,向![]() 的蒸馏水中加入
的蒸馏水中加入![]() 晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
A.该溶液中![]() 浓度为
浓度为![]()
B.由水电离出来的![]() 的浓度是
的浓度是![]()
C.加入的![]() 的物质的量为
的物质的量为![]()
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,取0.lmolL-1HA溶液与0.1molL-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因______(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)______0.1molL-1NaOH溶液中由水电离出的c(OH-)(填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:______。
(4)混合液中:c(HA)+c(A-)=______molL-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH______7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序______(填字母)。
A. NH4HCO3B. NH4AC. NH4HSO4D. NH4Cl
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
|温度/ ℃ | 700 | 900 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____________,△H____0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)=_____mol·L-1, C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为_____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_________;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_____________。
A(g)+B(g)的平衡常数的值为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com