
科目: 来源: 题型:
经测定甲、乙两种溶液中共含12种离子(不考虑水的电离):
①取少量甲溶液,滴加足量的稀盐酸,仅看到溶液中有淡黄色沉淀生成,没有闻到刺激性气味;②取乙溶液加入过量氨水,静置,取上层清液,做焰色反应实验,火焰为黄色,透过蓝色钴玻璃片观察不到紫色火焰. 下列有关推断正确的是( ) |
查看答案和解析>>
科目: 来源: 题型:
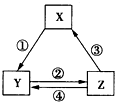 下表各组物质之问通过一步反应不可能实现如图所示转化关系的是( ) 下表各组物质之问通过一步反应不可能实现如图所示转化关系的是( )
|
查看答案和解析>>
科目: 来源: 题型:
下列关于物质分类的组合正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:阅读理解
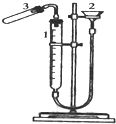 利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0mol?L-1的H2SO4)
利用右图装置测定金属镁的相对原子质量.请根据要求回答有关问题:(所提供试剂有:0.48克镁带、18.4mol?L-1的H2SO4、2.0mol?L-1的H2SO4)查看答案和解析>>
科目: 来源: 题型:
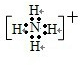
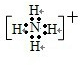


查看答案和解析>>
科目: 来源: 题型:
 用右图所示装置进行实验,将A逐滴加入B中;
用右图所示装置进行实验,将A逐滴加入B中;| 水溶 |
| △ |
| 水溶 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com