
科目: 来源: 题型:
【题目】下列各表述与示意图一致的是( )
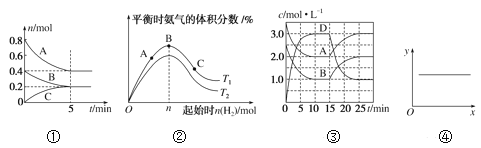
A. ①反应从开始到平衡的平均速率v(B)=0.04mol·L-1·min-1
B. ②N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
2NH3(g) ΔH<0,T1和T2表示温度,则:T1>T2
C. ③A(g)+B(g)![]() C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
C(s)+2D(g) ΔH>0,反应至15min时,改变的条件是降低温度
D. ④2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
N2(g)+2CO2(g) ΔH=-746.8kJ·mol-1,当x表示温度时,y表示平衡常数K
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)用O2将HCl转化为Cl2,可提高效益,减少污染.传统上该转化通过如图所示的催化剂循环实现,其中,反应①为 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() 反应②生成1molCl2(g)的反应热为
反应②生成1molCl2(g)的反应热为![]() ,则总反应的热化学方程式为_______________(反应热△H用含
,则总反应的热化学方程式为_______________(反应热△H用含![]() 和
和![]() 的代数式表示)。
的代数式表示)。
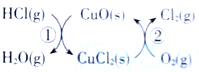
(2)在容积为1L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①该反应的![]() ____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
____________0(填“>”或“<”);100℃时,体系中各物质浓度随时间变化如下表所示。在0~60s时段,反应速率υ(N2O4)为_________mol·L-1·s-1;40s时C2___________0.10mol/L(填“>”或“<”)。
②100℃时达平衡后,改变反应温度为![]() ,c(N2O4)以0.0020 mol·L
,c(N2O4)以0.0020 mol·L![]() ·s
·s![]() 的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
的平均速率降低,经10s又达到平衡。则T______100℃(填“>”或“<”)。
③计算温度T时反应的平衡常数K___________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向___________(填“正反应”或“逆反应”)方向移动,N2O4的转化率______(填“增大”或“减小”)。
时间(s) | 0 | 20 | 40 | 60 | 80 |
N2O4浓度 (mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2浓度 (mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法对应的离子方程式合理的是
A. 纯碱溶液去油污:CO32-+H2O=HCO3-+OH-
B. 泡沫灭火器工作原理:2Al3++3CO32-+3H2O= 2A1(OH)3↓+3CO2↑
C. 明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-=BaSO4↓+AlO2-+2H2O
D. 用石墨为电极,电解Pb(NO3)2和Cu(NO3)2的混合溶液制取PbO2时,阳极上发生的电极反应式:Pb2++2 H2O-2e-=PbO2+4H+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作、现象及得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有品红的两只试管中分别通入SO2和Cl2 | 品红均褪色 | 两者漂白原理相同 |
B | 向体积相同且pH均为3.3的一元酸HX和HY中分别加入足量锌粒 | 产生的H2前者比后者多 | HX、HY均是弱酸 |
C | 在难溶性FeS和CuS中分别加入0.3mol/L盐酸 | 前者溶解,后者不溶 | Ksp(FeS)>Ksp(CuS) |
D | 向盛有相同体积、10%H2O2溶液的两只试管中分别加入足量酸性KMnO4溶液和FeCl3溶液 | 前者产生的气体多 | KMnO4催化活性比FeCl3高 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】苯甲酸的电离方程式为![]()
![]()
![]() +H+,其Ka=6.25×10-5,苯甲酸钠(
+H+,其Ka=6.25×10-5,苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,H2CO3的Ka1=4.17×l0-7,Ka2=4.90×l0-11。在生产碳酸饮料的过程中,除了添加NaA外, 还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,H2CO3的Ka1=4.17×l0-7,Ka2=4.90×l0-11。在生产碳酸饮料的过程中,除了添加NaA外, 还需加压充入CO2气体。下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
A. H2CO3的电离方程式为 H2CO3![]() 2H++CO32-
2H++CO32-
B. 提高CO2充气压力,饮料中c(A-)不变
C. 当pH为5.0时,饮料中 =0.16
=0.16
D. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
查看答案和解析>>
科目: 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是________________________
(3)吸收液吸收SO2的过程中,pH随n(SO3﹣):n(HSO3﹣)变化关系如下表:
n(SO﹣):n(HSO﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:____________
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____________
a.c(Na+)=2c(SO32-)+c(HSO3-),
b.c(Na+)> c(HSO3-)> c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
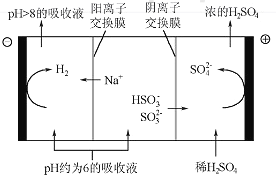
①HSO3-在阳极放电的电极反应式是_______________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:__________
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是:( )
A.加入合金的质量不可能为6.4g
B.沉淀完全时消耗NaOH溶液的体积为120mL
C.溶解合金时收集到NO气体的体积在标准状况下为2.24L
D.参加反应的硝酸的物质的量为0.2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的有几个( )
(1)强电解质溶液的导电能力不一定比弱电解质溶液强
(2)将氢氧化钠溶液和氨水各稀释一倍,氢氧根浓度均减小为原来的—半
(3)如果盐酸的浓度是醋酸浓度的2倍,则盐酸的氢离子浓度也是醋酸的2倍
(4)减少反应物的用量,平衡一定逆向移动
(5)离子化合物一定是电解质
(6)非电解质的水溶液一定不能导电
A. 1个 B. 2个 C. 3个 D. 4个
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,相关示意图像错误的是:
A. 将二氧化硫通入到一定量氯水中
将二氧化硫通入到一定量氯水中
B. 将氨水滴入到一定量氯化铝溶液中
将氨水滴入到一定量氯化铝溶液中
C. 将铜粉加入到一定量浓硝酸中
将铜粉加入到一定量浓硝酸中
D. 将铁粉加入到一定量氯化铁溶液中
将铁粉加入到一定量氯化铁溶液中
查看答案和解析>>
科目: 来源: 题型:
【题目】反应COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
CO(g)+Cl2(g) ΔH>0,达到平衡时,下列措施:
①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com