
科目: 来源: 题型:
【题目】某化学实验室需要0.2mol·L-1 的NaOH溶液500mL和0.5mol·L-1的硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___(填序号),配制上述溶液还需用到的玻璃仪器是____(填仪器名称)。

(2)容量瓶是配制溶液的主要仪器,容量瓶上标有以下六项中的___(填写序号)。
①温度 ②浓度 ③容量 ④压强 ⑤酸式或碱式 ⑥刻度线
(3)配制时,其正确的操作顺序是___(用字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算好的氢氧化钠固体于烧杯中,再加入少量水(约50mL),用玻璃棒慢慢搅动,使其充分溶解,冷却到室温
C.将容量瓶盖紧,摇匀
D.将溶解的氢氧化钠溶液沿玻璃棒注入容量瓶中
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)根据计算,配制0.2mol·L-1的 NaOH溶液500mL需NaOH固体的质量为__g。
(5)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___。
(6)将所配制的稀H2SO4进行测定,发现实际浓度小于0.5mol·L-1。请你分析下列哪些操作会引起所配浓度偏小_____(填字母)。
A.用量筒量取浓硫酸时,仰视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.烧杯未进行洗涤
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】某Na2CO3样品中含有KCl和NaCl杂质。经分析知含钠31.5%,含氯27.08%(以上均为质量分数),样品中含Na2CO3的质量分数为( )
A.25%
B.50%
C.80%
D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是___________(用离子方程式表示).
(2)物质的量浓度相同的CH3COOH 溶液和NaOH 溶液混合后,溶液中c(CH3COO)=c(Na+),则CH3COOH 溶液的体积_____NaOH 溶液的体积.(填“大于”、“小于”或“等于”.)
(3)常温下,取0.2molL﹣1 HCl溶液与0.2molL﹣1 MOH溶液等体积混合,测得混合溶液后的pH=5.写出MOH的电离方程式:_______________________.
(4)含![]() 的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的
的废水毒性较大,某工厂废水中含5.0×10﹣3 molL﹣1的![]() .为了使废水的排放达标,进行如下处理:
.为了使废水的排放达标,进行如下处理:
![]()
①绿矾为FeSO47H2O.反应(I)中Cr2O72﹣与FeSO4的物质的量之比为_____.
②常温下若处理后的废水中c(Cr3+)=6.0×10﹣7 molL﹣1,则处理后的废水的pH=_____(Ksp[Cr(OH)3]=6.0×10﹣31)
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)
已知:CO(g)+2H2(g)=CH3OH(g) △H1=-90.1kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1kJ/mol
2 CH3OH(g) = CH3OCH3(g)+H2O(g) △H3=-24.5kJ/mol
则反应2CO2(g)+6H2(g)= CH3OCH3(g)+3H2O(g) △H=________。
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解200mL饱和食盐水(惰性电极),电解一段时间后,阴极收集到标况下的氢气2.24L(设电解后溶液体积不变)
①二甲醚燃料电池的正极反应式为_____________,负极反应式为___________。
②请写出电解食盐水的化学方程式_______________________。
③电解后溶液的pH=_________,理论上消耗二甲醚的质量为___________(保留一位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度和压强下,30L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是
A.该温度和压强可能是标准状况
B.标准状况下该纯净物若为气态,其体积约是22.4L
C.该气体中每个分子含有2个原子
D.若O2在该条件下为气态,则1mol O2在该条件下的体积也为30L
查看答案和解析>>
科目: 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是( )

A.过程Ⅰ反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程Ⅱ,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液并加热,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是
A. 0.2mol·L-1Na2SO4溶液中含有Na+和SO42—总物质的量为0.6mol
B. 50mL 2mol·L-1的NaCl溶液和100 mL L 0.5mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等
C. 用1L水吸收22.4L氯化氢(标况下)所得盐酸的浓度是1mol·L-1
D. 10g 98%的硫酸(密度为1.84g·cm—3)与10mL 18.4mol·L—1的硫酸的浓度是相同的
查看答案和解析>>
科目: 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述错误的是( )
A.2 g D![]() O中含有的质子数、中子数、电子数均为NA
O中含有的质子数、中子数、电子数均为NA
B.含有NA个“Cu”微粒的CuO和Cu2S混合物质量为80 g
C.标准状况下,5.6 L氧气作氧化剂时转移电子数一定为NA
D.58.5 g NaCl晶体中含有NA个Na+
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
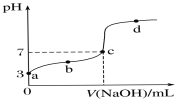
A.a点表示的溶液中c(H+)等于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中![]() 均等于K
均等于K
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)= 2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.①②④B.③④⑥C.④⑤⑥D.③⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com