
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值。下列说法正确的是( )
A.将0.2 molFeCl3 水解制成胶体,所得胶体粒子数为0.2 NA
B.25℃时,1LpH=13的Ba(OH)2溶液中含有OH-离子数为0.2 NA
C.0.1mol·L1 NH4Cl溶液中 NH![]() 数小于0.1 NA
数小于0.1 NA
D.1L 2mol·L1K2S溶液中H2S、S2-和HS-的总数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】H(3-溴-5-甲氧基苯甲酸甲酯)是重要的有机物中间体,可以由A(C7H8)通过下图路线合成。

请回答下列问题:
(1)C的化学名称为________,G中所含的官能团有醚键、_______(填名称)。
(2)B的结构简式为________,B生成C的反应类型为___________。
(3)由G生成H的化学方程式为___________。
(4)化合物F的同分异构体中能同时满足下列条件的共有________种。
①氨基和羟基直接连在苯环上 ②苯环上有三个取代基且能发生水解反应
(5)设计用对硝基乙苯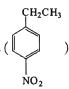 为起始原料制备化合物
为起始原料制备化合物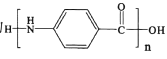 的合成路线(其他试剂任选)。_________________________
的合成路线(其他试剂任选)。_________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】回答下列问题。
(1)常温时,FeCl3 溶液的pH___7(填“>”、“<”或“=”),原因是(用离子方程式表示________)
(2)常温时,Na2CO3溶液的pH____7(填“>”、“<”或“=”),原因是(用离子方程式表示______)
(3)用石墨作电极电解AgNO3溶液,电解一段时间后溶液的酸性_____(填“增强”、或“减弱”),阳极产物是_______,阴极产物是______,电解反应的总方程式为________;
(4)用石墨作阳极,铁作阴极电解Na2SO4溶液,电解一段时间后溶液的酸性_____(填“增强”、“减弱”或“不变”),阳极产物是_______,阴极产物是______,电解反应的总方程式为__________;
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol/L,则此时v正____v逆(填“大于”“小于”或“等于”)。
②由表中的实验数据可得到“c—t”的关系,如图所示,表示c(N2)—t的曲线是______。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。

(3)NOx的排放主要来自于汽车尾气,有人利用反应C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
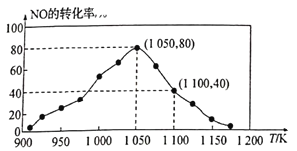
①由图可知,在1100K时,CO2的体积分数为__________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=______[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(4)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯![]() 原理如图所示
原理如图所示
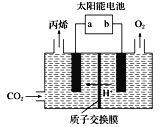
①太阳能电池的负极是_______(填“a”或“b”)
②生成丙烯的电极反应式是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】秸秆(含多糖类物质)的综合利用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是___。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为___。
(3)D中的官能团名称为___,D生成E的反应类型为___。
(4)F 的化学名称是___,由F生成G的化学方程式为____。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5molW与足量碳酸氢钠溶液反应生成44gCO2,W共有____种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为____。
(6)参照上述合成路线,以(反,反)2,4己二烯和C2H4为原料(无机试剂任选),设计制备对苯二甲酸的合成路线____。
查看答案和解析>>
科目: 来源: 题型:
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)=2G(g)忽略固体体积,平衡时G的体积分数![]() 随温度和压强的变化如表所示:
随温度和压强的变化如表所示:
| 1.0 | 2.0 | 3.0 |
810 | 54.0 | a | b |
915 | c | 75.0 | d |
1000 | e | f | 83.0 |
①b>f ②915℃,2.0MPa时E的转化率为60% ③该反应的S>0 ④K(1000℃)>K(810℃)。上述中正确的有
A.4个B.3个C.2个D.1个
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L恒容密闭容器中投入足量M(s)和一定量的R(g),发生反应为M(s)+R(g)![]() X(g)+Y(g) △H;所得实验数据如表所示:
X(g)+Y(g) △H;所得实验数据如表所示:
实验 | 温度/℃ | 起始时R的物质的量/mol | 平衡时气体总物质的量/mol |
① | 300 | 2.00 | 2.80 |
② | 400 | 2.00 | 3.00 |
③ | 400 | 4.00 | a |
下列推断正确的是( )
A.上述反应中,△H<0
B.实验②中,该反应的平衡常数K=0.5
C.实验①经4min达到平衡,0~4 min内υ(X)=0.2mol·L-1·min-1
D.实验③中a=6.00
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下进行反应:NO(g)+CO(g)=1/2N2(g)+CO2(g) ΔH=-373.2 kJ/mol。如图曲线a表示该反应过程中,NO的转化率与反应时间的关系,若改变起始条件,使反应过程按照曲线b进行,可采取的措施是( )

A. 加催化剂 B. 向密闭容器中加入氩气
C. 降低温度 D. 增大反应物中NO的浓度
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列图示所得出的结论正确的是

A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各表述与示意图一致的是
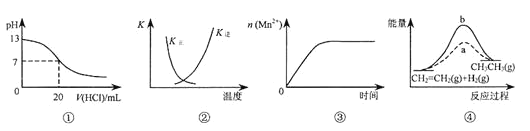
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com