
科目: 来源: 题型:
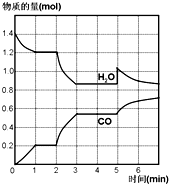 在一个体积为4L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0其中,H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示.
在一个体积为4L的密闭容器中,高温下发生下列反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0其中,H2O、CO的物质的量(mol)随时间(min)的变化曲线如图所示.查看答案和解析>>
科目: 来源: 题型:
 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.查看答案和解析>>
科目: 来源: 题型:
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ?mol-1 | 436 | 391 | 946 |
查看答案和解析>>
科目: 来源: 题型:

| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
| c(CH3OH)×c(H2O) |
| c(CO2)×c3(H2) |
查看答案和解析>>
科目: 来源: 题型:
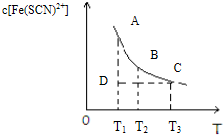 FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq).已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是( )
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq).已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是( )查看答案和解析>>
科目: 来源: 题型:
 一定条件下,在体积为3L的密闭容器中,通入一定物质的量的CO和H2,发生如下反应:CO(g)+2H2(g)?CH3OH(g),在不同温度下测得甲醇的物质的量随时间的变化如图所示.下列叙述不正确的是( )
一定条件下,在体积为3L的密闭容器中,通入一定物质的量的CO和H2,发生如下反应:CO(g)+2H2(g)?CH3OH(g),在不同温度下测得甲醇的物质的量随时间的变化如图所示.下列叙述不正确的是( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com