
科目: 来源: 题型:
【题目】利用如图所示的装置和其他必要的仪器用品,完成下列实验。

已知2NH3+3CuO![]() N2+3Cu+3H2O,该实验证明氨气具有还原性。
N2+3Cu+3H2O,该实验证明氨气具有还原性。
(1)碱石灰的作用是______________,倒扣漏斗的作用是___________________。
(2)浓氨水与固体NaOH接触,会逸出大量氨气原因是______________________。
(3)硬质玻璃管中可观察到的实验现象是_________________________________。
(4)常温下,若氨水与稀硫酸恰好完全中和,则所得溶液中各离子浓度的大小顺序为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式或化学反应方程式与所述事实相符且正确的是
A.将![]() 气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:
气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:![]()
B.将少量![]() 气体通入NaClO溶液中:
气体通入NaClO溶液中:![]()
C.![]() 溶液中加入
溶液中加入![]() 溶液使
溶液使![]() 完全沉淀:
完全沉淀:![]()
D.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:
充分反应:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ( )
A.C(s)+O2(g)=CO2(g) ΔH1 C(s)+![]() O2(g)=CO(g) ΔH2
O2(g)=CO(g) ΔH2
B.S(g)+O2(g)=SO2(g) ΔH3 S(l)+O2(g)=SO2(g) ΔH4
C. 2H2(g)+O2(g)=2H2O(l) ΔH5 H2(g)+![]() O2(g)=H2O(l) ΔH6
O2(g)=H2O(l) ΔH6
D.CaCO3(s)=CaO(s)+CO2(g) ΔH7 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH8
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为几种晶体或晶胞的示意图:


请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是____。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:___。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能___(填“大于”或“小于”)MgO晶体,原因是____。
(4)每个Cu晶胞中实际占有___个Cu原子,CaCl2晶体中Ca2+的配位数为__。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】在体积为1L的密闭容器中![]() 体积不变
体积不变![]() 充入
充入![]() 和
和![]() ,一定条件下发生反应:
,一定条件下发生反应:![]() ,测得
,测得![]() 和
和![]() 的浓度随时间变化如图所示。下列说法正确的是
的浓度随时间变化如图所示。下列说法正确的是
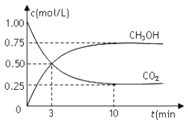
A.从反应开始到平衡,氢气的平均反应速率为![]()
B.进行到3min时,正反应速率和逆反应速率相等
C.10min后容器中各物质的量浓度不再改变
D.到达平衡状态时,反应放出![]() 的能量
的能量
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在实验室进行铁盐与亚铁盐相互转化的实验:
实验Ⅰ:将![]() 转化为
转化为![]() 如图
如图![]()
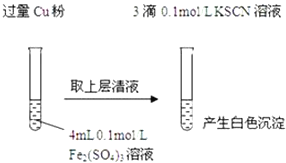
(1)Fe3+与Cu粉发生反应的离子方程式为______.
(2)探究白色沉淀产生的原因,请填写实验方案:查阅资料:
![]() 的化学性质与
的化学性质与![]() 相似,
相似,![]() 白色
白色![]()
实验方案 | 现象 | 结论 |
步骤1:取4mL ______ | 产生白色沉淀 |
|
步骤2:取 ______ | 无明显现象 |
![]() 与
与![]() 反应的离子方程式为______.
反应的离子方程式为______.
实验Ⅱ:将![]() 转化为
转化为![]()
实验方案 | 现象 |
向3mL | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因:查阅资料:![]() 棕色
棕色![]()
(3)用离子方程式解释NO产生的原因______.
(4)从化学反应速率与限度的角度对体系中存在的反应进行
反应Ⅰ:![]() 与
与![]() 反应;反应Ⅱ:
反应;反应Ⅱ:![]() 与NO反应
与NO反应
①依据实验现象,甲认为反应Ⅰ的速率比反应Ⅱ______![]() 填“快”或“慢”
填“快”或“慢”![]() .
.
②乙认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙设计的实验方案是______.
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因______.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A.在固定体积的密闭容器中发生可逆反应![]() ,当混合气体的压强不再改变时,说明已达到化学平衡状态
,当混合气体的压强不再改变时,说明已达到化学平衡状态
B.对于反应![]()
![]() ,改变某一条件,若化学平衡常数增大,则反应速率也一定增大
,改变某一条件,若化学平衡常数增大,则反应速率也一定增大
C.将![]() 的
的![]() 加水稀释,则溶液中
加水稀释,则溶液中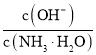 减小
减小
D.常温下向![]() 悬浊液中加入
悬浊液中加入![]() 浓溶液后,溶液中
浓溶液后,溶液中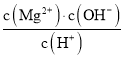 不变
不变
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应![]() 的能量变化如图所示,下列说法正确的是
的能量变化如图所示,下列说法正确的是
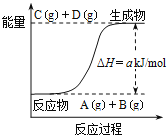
A.该体系的压强不变时标志此反应处于平衡状态
B.若该反应中有电子得失,则可设计成原电池
C.反应物的总键能高于生成物的总键能
D.该反应中的反应物A和B的转化率一定相同
查看答案和解析>>
科目: 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设![]() 为阿伏伽德罗常数的值,下列说法正确的有
为阿伏伽德罗常数的值,下列说法正确的有
①![]() 和
和![]() 在
在![]() 存在的条件下于密闭容器中加热充分反应后,容器内物质分子数等于
存在的条件下于密闭容器中加热充分反应后,容器内物质分子数等于![]()
②![]() 甲基
甲基![]() 所含电子数为
所含电子数为![]()
③在精炼铜或电镀铜的过程中,当阴极析出32g铜转移电子数均为![]()
④含![]() 的浓硫酸与足量铜反应,生成
的浓硫酸与足量铜反应,生成![]() 的分子数为
的分子数为![]()
⑤![]() 白磷晶体中含有的
白磷晶体中含有的![]() 键数是
键数是![]()
⑥![]() 的
的![]() 和
和![]() 混合物中,含硫原子总数为
混合物中,含硫原子总数为![]()
⑦![]() 过氧化钡
过氧化钡![]() 固体中阴、阳离子总数为
固体中阴、阳离子总数为![]()
A.2个B.3个C.4个D.5个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com