
【题目】下列离子方程式或化学反应方程式与所述事实相符且正确的是
A.将![]() 气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:
气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:![]()
B.将少量![]() 气体通入NaClO溶液中:
气体通入NaClO溶液中:![]()
C.![]() 溶液中加入
溶液中加入![]() 溶液使
溶液使![]() 完全沉淀:
完全沉淀:![]()
D.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:
充分反应:![]()
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
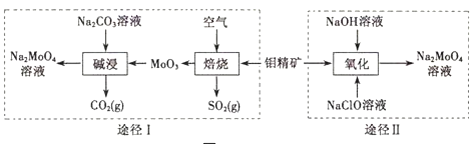
(1)钼和锆同属过渡金属,锆元素是核反应堆燃料棒的包裹材料,锆合金在高温下与水蒸气反应产生氢气,二氧化锆可以制造耐高温纳米陶瓷.下列关于锆、二氧化锆的叙述中,正确的是______(填序号)
A 锆合金比纯锆的熔点高,硬度小
B 二氧化锆陶瓷属于新型无机非金属材料
C 将一束光线通过纳米级二氧化锆会产生一条光亮的通路
(2)①途径I碱浸时发生反应的离子方程式为______.
②途径Ⅱ氧化时发生反应的离子方程式为______.
(3)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是______.
(4)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图:
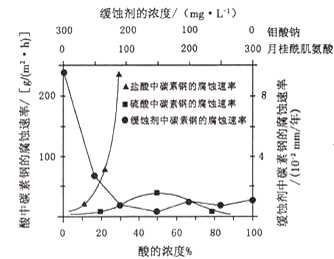
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为______。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是______。
(5)锂和二硫化钼形成的二次电池的总反应为:xLi+nMoS2![]() Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
Lix(MoS2)n,则电池放电时的正极反应式是:______.回收使用率为50%的该电池,利用途径I,使所有的Mo转化为钼酸钠晶体,得到a克的Na2MoO42H2O(分子量为M),则需要空气(含O2为20%)在标况下的体积为______L(用x、M、n表示,并化为最简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:


①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(“增大”或“减小”)。
(2)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的ΔH______0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为__________________;平衡时混合气体中NO2的体积分数为_______。
②100℃时达平衡后,向容器中迅速充入含0.08mol的NO2和0.08mol N2O4 的混合气体,此时速率关系v(正)____v(逆)。(填“大于”,“等于”,或“小于”)
③100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a.T________100℃(填“大于”或“小于”),判断理由是____________________
b.列式计算温度T时反应的平衡常数K2(写计算过程):______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.![]() 在常温下即可进行,说明正反应是放热反应
在常温下即可进行,说明正反应是放热反应
B.汽车尾气催化净化时的反应:![]()
![]() ,平衡常数为
,平衡常数为![]() ;若反应在绝热容器中进行,平衡常数为
;若反应在绝热容器中进行,平衡常数为![]() ;则
;则![]()
C.某恒容密闭容器中反应:![]()
![]() 已达平衡,则升温时
已达平衡,则升温时![]() 的值减小
的值减小
D.恒温恒容密闭容器中反应:![]() ,混合气体的密度不再改变时说明反应已达平衡
,混合气体的密度不再改变时说明反应已达平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.在固定体积的密闭容器中发生可逆反应![]() ,当混合气体的压强不再改变时,说明已达到化学平衡状态
,当混合气体的压强不再改变时,说明已达到化学平衡状态
B.对于反应![]()
![]() ,改变某一条件,若化学平衡常数增大,则反应速率也一定增大
,改变某一条件,若化学平衡常数增大,则反应速率也一定增大
C.将![]() 的
的![]() 加水稀释,则溶液中
加水稀释,则溶液中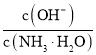 减小
减小
D.常温下向![]() 悬浊液中加入
悬浊液中加入![]() 浓溶液后,溶液中
浓溶液后,溶液中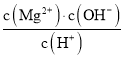 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍,A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是__;
(2)已知:
ⅰ.![]() (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ.![]()
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去.

请回答:
①步骤Ⅰ的目的是__;
②若G为气体,且相对分子质量是44,则E的结构简式是__;E的核磁共振氢谱中有__个吸收峰(填数字);
③F→H的反应类型是__;
④F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式__;
⑤A的结构简式是__;
上述转化中B→D的化学方程式是__;
(3)已知A的某种同分异构体K具有如下性质:
①K与FeCl3反应,溶液呈紫色
②K在一定条件下可发生银镜反应
③K分子中苯环上的取代基上无甲基
请写出K所有可能的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成氢气的总量,可向盐酸中加适量的( )
①NaOH(s) ②NH4Cl(s) ③H2O ④CH3COONa(s)
A.①③B.②④C.③④D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸![]() 是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用
是染料、医药等工业的重要原料;溶于浓硫酸,可在浓硫酸存在时用![]() 和浓硝酸反应制得。测定产品的纯度:准确称取1.5g产品放入锥形瓶中,加入
和浓硝酸反应制得。测定产品的纯度:准确称取1.5g产品放入锥形瓶中,加入![]() 、100.00mL的
、100.00mL的![]() 溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
溶液和足量稀硫酸,摇匀充分反应。然后用0.5000mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为30.00mL。
已知:![]()
①草酸钠与高锰酸钾溶液反应的离子方程式为_________。
②滴定终点的现象为____________。
③亚硝酰硫酸的纯度![]() ________。[保留三位有效数字,M(NOSO4H)=127g/mol]
________。[保留三位有效数字,M(NOSO4H)=127g/mol]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com