
【题目】下列说法不正确的是
A.![]() 在常温下即可进行,说明正反应是放热反应
在常温下即可进行,说明正反应是放热反应
B.汽车尾气催化净化时的反应:![]()
![]() ,平衡常数为
,平衡常数为![]() ;若反应在绝热容器中进行,平衡常数为
;若反应在绝热容器中进行,平衡常数为![]() ;则
;则![]()
C.某恒容密闭容器中反应:![]()
![]() 已达平衡,则升温时
已达平衡,则升温时![]() 的值减小
的值减小
D.恒温恒容密闭容器中反应:![]() ,混合气体的密度不再改变时说明反应已达平衡
,混合气体的密度不再改变时说明反应已达平衡
科目:高中化学 来源: 题型:
【题目】活性ZnO在橡胶、塑料、涂料工业有重要应用,工业上用含锌物料(含FeO、CuO等杂质)制取活性ZnO的流程如图所示:

(1)上述流程中,浸出时用的是60% H2SO4(密度是1.5 g/cm3),则该H2SO4的物质的量浓度为______________ (保留两位小数) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的浓度为0.04 mol·L-1,控制滤液的pH,加入H2O2后产生大量红褐色沉淀。
①粗略测定溶液pH的实验操作是___________________________________________。
②已知:常温下Fe(OH)3的Ksp=4.0×10-38。滤液的pH至少为________时,溶液中Fe3+开始沉淀。
(3)A溶液中主要含有的溶质是______________,验证溶质所含阳离子的方法是_____________。
(4)制备ZnO所焙烧的物质是含结晶水的碱式碳酸锌。取碱式碳酸锌6.82g,溶于HCl生成CO2 448 mL(标准状况下),溶解过程消耗HCl 0.12mol,若该碱式盐中氢元素的质量分数为1.76%,试推测该碱式碳酸锌的化学式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气中![]() 主要含
主要含![]() 、
、![]() 的
的![]() 形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:
形成酸雨、污染大气,对烟气进行脱硫,回答下列问题:

(1)采用![]() 烟气脱硫可得到较好的效果.已知下列反应:
烟气脱硫可得到较好的效果.已知下列反应:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
则反应![]()
![]()
![]()
![]() 的
的![]() ______ .
______ .
(2)采用氨水烟气脱硫,最终可得到氮肥.将相同物质的量的![]() 与
与![]() 溶于水所得溶液中
溶于水所得溶液中![]() ______
______ ![]() 填字母编号
填字母编号![]() .
.
A.![]() /span>
/span>![]()
C.![]()
![]()
(3)烟气在较高温度经如图1方法脱除![]() ,并制得
,并制得![]() .
.
①在阴极放电的物质是 ______ .
②在阳极生成![]() 的电极反应式是 ______ .
的电极反应式是 ______ .
③已知室温下,![]() 将脱除
将脱除![]() 后制得的
后制得的![]() 配成
配成![]() 的
的![]() 溶液,与
溶液,与![]() 的
的![]() 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的![]() ,则
,则![]() 溶液与
溶液与![]() 溶液的体积比为 ______
溶液的体积比为 ______ ![]() 欲使溶液中
欲使溶液中![]() ,则应保持溶液中
,则应保持溶液中![]() ______
______ ![]() .
.
(4)一定条件下,用![]() 、NiO或
、NiO或![]() 作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:
作催化剂,利用如下反应回收燃煤烟气中的硫.反应为:![]()
![]() 其他条件相同、催化剂不同时,
其他条件相同、催化剂不同时,![]() 的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择 ______ 为该反应的催化剂较为合理
的转化率随反应温度的变化如图2,不考虑催化剂的价格因素,选择 ______ 为该反应的催化剂较为合理![]() 选填序号
选填序号![]() ;
;
![]()
![]()
![]()
选择该催化剂的理由是: ______ .
某科研小组用选择的催化剂,在![]() 时,研究了
时,研究了![]() :
:![]() 分别为1:1、3:1时,
分别为1:1、3:1时,![]() 转化率的变化情况
转化率的变化情况![]() 图
图![]() 则图3中表示
则图3中表示![]() :
:![]() :1的变化曲线为 ______ .
:1的变化曲线为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为合成1丁醇,查阅资料得知一条合成路线:CH3CH===CH2+CO+H2→CH3CH2CH2CHO![]() CH3CH2CH2CH2OH,CO的制备原理:HCOOH
CH3CH2CH2CH2OH,CO的制备原理:HCOOH![]() CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。
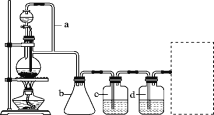
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2丙醇,从中选择合适的试剂制备氢气、丙烯。写出化学方程式:______________________________________________。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是________、________;c和d中盛装的试剂分别是________、________。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1丁醇粗品,为纯化1丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和)―→RCH(OH)SO3Na↓;②沸点:乙醚 34 ℃,1丁醇 118 ℃,并设计出如下提纯路线:
粗品![]() 滤液
滤液![]() 有机层
有机层![]() 1丁醇、乙醚
1丁醇、乙醚![]() 纯品
纯品
试剂1为________,操作1为________,操作2为________,操作3为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球“最强悍”工程,“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料,有关说法正确的是
A.ETFE膜![]() 是由两种单体缩聚而成的
是由两种单体缩聚而成的
B.已知Ga处于ⅢA族,可推知氮化镓化学式为Ga3N2
C.合金的熔点通常比组分金属高,硬度比组分金属小
D.用金属铝与V2O5冶炼钒,铝作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学反应方程式与所述事实相符且正确的是
A.将![]() 气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:
气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:![]()
B.将少量![]() 气体通入NaClO溶液中:
气体通入NaClO溶液中:![]()
C.![]() 溶液中加入
溶液中加入![]() 溶液使
溶液使![]() 完全沉淀:
完全沉淀:![]()
D.向含有![]() 的溶液中通入
的溶液中通入![]() 充分反应:
充分反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Zn(OH)2的溶度积常数为1.2×10-17(mol·L-1)3,则Zn(OH)2在水中的溶解度为( )
A.1.4×10-6mol·L-1B.2.3×10-6mol·L-1
C.1.4×10-9mol·L-1D.2.3×10-9mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块Al-Fe合金,溶于足量的盐酸中,再用过量的NaOH溶液处理,将产生的沉淀过滤、洗涤、干燥、灼烧完全变成红色粉末后,经称量,红色粉末的质量恰好与合金的质量相等,则合金中铝的质量分数为( )
A.70%B.30%C.47.6%D.52.4%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com