
科目: 来源: 题型:
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应:3A(g) ![]() 3B+C△H > 0,随着温度升高,气体平均分子质量有变小趋势,则下列判断正确的是( )
3B+C△H > 0,随着温度升高,气体平均分子质量有变小趋势,则下列判断正确的是( )
A.若C为固体,则B一定是气体B.B和C一定都是固体
C.B和C可能都是固体D.B和C不可能都是气体
查看答案和解析>>
科目: 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图一、图二所示的实验。
(1)可通过观察图一的现象:_______________,而定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是_____________,你认为还可以作何改进?____________________。
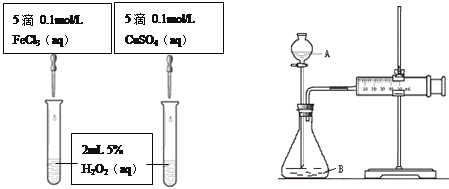
图一 图二
(2)检查图二装置气密性的方法是_______________________。图二所示实验中需测量的数据是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知一定温度和压强下,在容积为VL的密闭容器中充入1 mol A和1 mol B,保持恒温恒压下反应:A(g)+B(g)![]() C(g) ΔH<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) ΔH<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率________(填“加快”“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡________(填字母)。
A 一定向正反应方向移动 B 一定向逆反应方向移动
C 一定不移动 D 不一定移动
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应 CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH<0。在恒温恒压密闭容器中,反应达到平衡。下列叙述正确的是( )。
CO2(g) + H2(g) ΔH<0。在恒温恒压密闭容器中,反应达到平衡。下列叙述正确的是( )。
A.充入一定量的氙气,n(H2)不变B.增大压强,n(CO2)减小
C.更换高效催化剂,CO 转化率增大D.降低温度,平衡常数 K 减小
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,合成氨反应的热化学方程式为:
N2(g)+3H2(g)![]() 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1
在该温度下,取1molN2和3molH2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量总是小于92.4 kJ是______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,可逆反应N2+3H2![]() 2NH3达到化学平衡状态,下列说法一定正确的是( )
2NH3达到化学平衡状态,下列说法一定正确的是( )
A.每1 mol N≡N断裂的同时有2 mol N—H生成
B.N2、H2、NH3的浓度之比为1∶3∶2
C.N2减少的速率和NH3减少的速率之比为1∶2
D.气体体积为初始体积的0.7倍
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A.任意时刻:3υ正(NH3)= 2υ正(H2O)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,增大压强,则逆反应速率增大,正反应速率减小
D.达到化学平衡时,5υ正(O2)= 4υ逆(NO )
查看答案和解析>>
科目: 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳来衡量(总有机碳=水样中有机物所含碳元素的质量/水样的体积)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
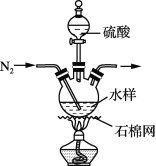
步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置见上图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热充分反应,生成的CO2完全被100 mL 0.205 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500 mL溶液。量取25.00 mL溶液于锥形瓶中,加入指示剂,并滴加0.050 00 mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4=BaC2O4↓+2H2O。恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是__________________________________。
(2)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。_______________
(3)用上述实验方法测定的水样总有机碳一般低于实际值,其原因可能是(写出一条即可)____
(4)高温燃烧可将水样中的碳酸盐、碳酸氢盐和有机物所含碳元素转化为CO2,结合高温燃烧的方法,改进上述实验。
①请补充完整改进后的实验方案:取V L的水样,分为两等份;将其中一份水样高温燃烧,测定生成CO2的物质的量为n1 mol;__________,测定生成CO2的物质的量为n2 mol。
②利用实验数据计算,所取水样的总有机碳为_____________mg·L-1(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com