
科目: 来源: 题型:
【题目】市场上经常见锂离子电池,它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
Li + 2Li0.35NiO2![]() 2Li0.5NiO2。下列说法不正确的是 ( )
2Li0.5NiO2。下列说法不正确的是 ( )
A.放电时,负极的电极反应式:Li — e-= Li+
B.该电池不能用水溶液作为电解质
C.充电时,Li0.5NiO2既发生氧化反应又发生还原反应
D.放电过程中Li+向负极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】一种从植物中提取的天然化合物a-damascone,可用于制作“香水”,其结构为:
 ,有关该化合物的下列说法不正确的是
,有关该化合物的下列说法不正确的是
A. 分子式为![]() B. 该化合物可发生聚合反应C. 1mol该化合物完全燃烧消耗19mol
B. 该化合物可发生聚合反应C. 1mol该化合物完全燃烧消耗19mol![]() D. 与溴的
D. 与溴的![]() 溶液反应生成的产物经水解、稀硝酸化后可用
溶液反应生成的产物经水解、稀硝酸化后可用![]() 溶液检验
溶液检验
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.10mol·L-1盐酸分别滴定20.00mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积V(HCl)的变化关系如图。下列说法不正确的是( )
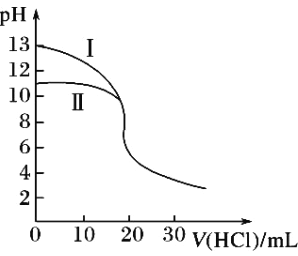
A. Ⅱ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20mL,则可能c(Cl-)>c(H+)>c(K+) >c(OH-)
D. 当滴定氨水消耗V(HCl)=10mL时,c(NH3H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃,下列有关电解质溶液的说法正确的是
A. 向NaF溶液中滴加硫酸至中性时,c(SO42-)<c(HF)
B. 稀醋酸中加入冰醋酸,醋酸电离平衡右移,电离度增大
C. 向氨水中加入NH4Cl固体,溶液中 增大
增大
D. 将CH3COONa溶液从20℃升温至30℃,溶液中 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
科目: 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下向20 mL 0.1 mol/L HA溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是

A. 由题可知HA为弱酸
B. 滴定终点位于c和d之间
C. 滴定到b点时:n(Na+)+ n(H+)-n(OH-)+ n(HA)=0.002 mol
D. 滴定到d点时:c(OH-)>c(Na+)>c(A-) >c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3溶液可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目: 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。若生成0.5molN2,下列说法不正确的是( )

A.反应生成1molN2时转移4mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139kJ·mol-1
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com