
科目: 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl![]() Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl![]() 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
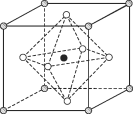
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醇是重要的有机化工原料,可由乙烯气相直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H),再水解生成乙醇。写出相应反应的化学方程式_______。
(2)已知:
甲醇脱水反应:2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应:2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应:CH3CH2OH(g)=CH3OCH3(g) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应 C2H4 (g)+H2O(g)C2H5OH(g)的△H=_______kJ·mol-1。与间接水合法相比,气相直接水合法的优点是______
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系:(其中nH2O:nC2H4=1:1)
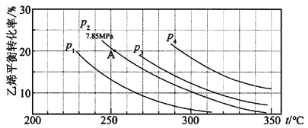
①列式计算乙烯水合制乙醇反应在图中 A 点的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强 P1、P2、P3、P4 的大小顺序为_______,理由是_______。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度 290 ℃,压强 6.9MPa, n H2 O ︰ nC2 H4 =0.6︰1。乙烯的转化率为 5℅,若要进一步提高乙烯的转化率, 除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】咖啡因是一种生物碱(易溶于水及乙醇,熔点234.5 ℃,100 ℃以上开始升华),有兴奋大脑神经和利尿等作用。茶叶中含咖啡因约1%~5%,单宁酸(Ka约为10-6,易溶于水及乙醇)约3%~10%,还含有色素、纤维素等。实验室从茶叶中提取咖啡因的流程如图所示:

索氏提取装置如图所示。实验时烧瓶中溶剂受热蒸发,蒸汽沿蒸汽导管2上升至球形冷凝管,冷凝后滴入滤纸套筒1中,与茶叶末接触,进行萃取。萃取液液面达到虹吸管3顶端时,经虹吸管3返回烧瓶,从而实现对茶叶末的连续萃取。回答下列问题:

(1)实验时需将茶叶研细,放入滤纸套筒1中,研细的目的是______________,圆底烧瓶中加入95%乙醇为溶剂,加热前还要加几粒______________。
(2)提取过程不可选用明火直接加热,原因是__________,与常规的萃取相比,采用索氏提取器的优点是_____。
(3)提取液需经“蒸馏浓缩”除去大部分溶剂,与水相比,乙醇作为萃取剂的优点是______________。“蒸馏浓缩”需选用的仪器除了圆底烧瓶、蒸馏头、温度计、接收管之外,还有______________(填标号)。
A.直形冷凝管 B.球形冷凝管C.接收瓶D.烧杯
(4)浓缩液加生石灰的作用是中和______________和吸收________。
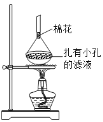
(5)可采用如图所示的简易装置分离提纯咖啡因。将粉状物放入蒸发皿中并小火加热,咖啡因在扎有小孔的滤纸上凝结,该分离提纯方法的名称是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度(T ℃)时,测得0.01 mol·L-1NaOH溶液的pH=11,则该温度下水的Kw=________。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=11,b=3,则Va∶Vb=__________。
(2)若所得混合液为中性,且Va∶Vb=10∶1,则a+b=__________。
(3)若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验的叙述正确的是

A. 用图1装置将氯化铁溶液直接蒸干得到氯化铁固体
B. 利用图2装置可制备Fe(OH)2
C. 图3微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 利用图4可收集氯化氢并进行尾气吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】已知锌及其化合物的性质与铝及其化合物相似。如图横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4 ]2-的物质的量浓度的对数。25℃时,下列说法中不正确的是

A. 往ZnCl2溶液中加入过量氢氧化钠溶液,反应的离子方程式为Zn2++4OH-=[Zn(OH)4]2-
B. 若要从某废液中完全沉淀Zn2+,通常可以调控该溶液的pH在8.0—12.0之间
C. pH=8.0与pH=12.0的两种废液中,Zn2+浓度之比为108
D. 该温度时,Zn(OH)2的溶度积常数(Ksp)为1×l0-10
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。
Ⅱ.肼(N2H4)可作为火箭发动机的燃料。
(2)肼(N2H4)与氧化剂N2O4(l)反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=-195 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
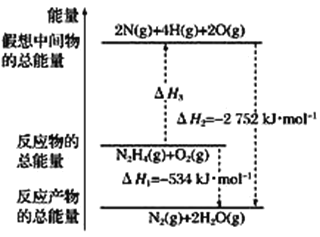
试计算1 mol肼(l)与N2O4(l)完全反应生成N2和水蒸气时放出的热量为________,写出肼(l)和N2O4(l)反应的热化学方程式:___________________________________________________。
(3)有关肼化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):
N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量是________ kJ。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.根据反应Cu+H2SO4![]() CuSO4+H2↑可推出Cu的还原性比H2的强
CuSO4+H2↑可推出Cu的还原性比H2的强
B.由置换反应I2+2NaClO3=2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
C.电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
D.含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
查看答案和解析>>
科目: 来源: 题型:
【题目】球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:
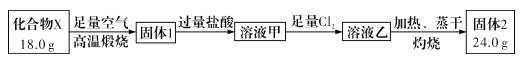
下列说法不正确的是
A. 固体2是氧化铁
B. X的化学式可以表示为Fe3C2
C. 将溶液甲在空气中加热、蒸干、灼烧也可得到24.0g固体
D. X与足量的热浓硝酸反应有NO2和CO2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁电池具有比能量高、无污染的特点,用下图模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是( )
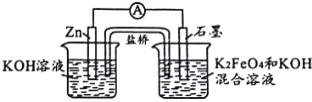
A.放电时,电子由正极通过外电路流向负极
B.放电时,负极上的电极反应式为:Zn—2e-+2H2O=Zn(OH)2+2H+
C.充电时,阴极区溶液的pH减小
D.充电时,阳极上的电极反应式为:Fe(OH)3—3e-+5OH-=FeO4 2-+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com