
科目: 来源: 题型:
【题目】下图为装有活塞的密闭容器,内盛22.4 mL一氧化氮。若通入11.2 mL氧气(气体体积均在标准状况下测定)保持温度、压强不变,则容器内气体的密度( )
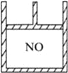
A. 等于1.369 g/LB. 等于2.054 g/L
C. 在1.369 g/L和2.054 g/L之间D. 大于2.054 g/L
查看答案和解析>>
科目: 来源: 题型:
【题目】图中的曲线是表示其他条件一定时,2NO(g)+O2(g)2NO2(g) ΔH<0反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v正>v逆的点是( )

A.a点
B.b点
C.c点
D.d点
查看答案和解析>>
科目: 来源: 题型:
【题目】下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应C(s)+H2O(g)![]() CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动 ②已达平衡的反应N2(g)+3H2(g)![]() 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高 ③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动 ④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
(1)硒常用作光敏材料,基态硒原子的核外电子排布式为[Ar]_______;与硒同周期的p区元素中第一电离能大于硒的元素有_____种;SeO3的空间构型是_______。
(2)根据元素周期律,原子半径Ga ___As,第一电离能Ga _____As。(填“大于”或“小于”)
(3)水晶的主要成分是二氧化硅,在水晶中硅原子的配位数是______,硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4 、SiBr4,上述四种物质的沸点由高到低的顺序为__________,丁硅烯(Si4H8)中σ键与π键个数之比为___。
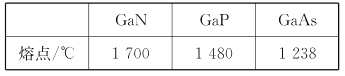
(4)GaN、GaP、GaAs都是很好的半导体材料,晶体类型与晶体硅类似,熔点如下表所示,分析其变化原因___。
(5)GaN晶体结构如图所示。已知六棱柱底边边长为a cm,阿伏加德罗常数的值为NA。
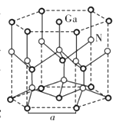
①晶体中Ga原子采用六方最密堆积方式,每个Ga原子周围距离最近的Ga原子数目为_____。
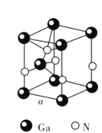
②从GaN晶体中“分割”出的平行六面体如图所示。若该平行六面体的体积为![]() cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
cm3,GaN晶体的密度为____g/cm3(用a、NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。
是一种重要的化工原料,可用于合成可降解的高聚物PES树脂以及具有抗肿瘤活性的化合物K。

已知:i.R1CO18OR2+R3OH![]() R1COOR3+R218OH
R1COOR3+R218OH
ii. 
ⅲ.  (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
(1)A的名称是_________;C的官能团的名称是_________。
(2)B分子为环状结构,核磁共振氢谱只有一组峰,B的结构简式为_________ .
(3)E分子中含有两个酯基,且为顺式结构,E的结构简式为_________ .
(4)反应①的化学方程式为_________ 。
(5)试剂a的结构简式为_________;反应②所属的反应类型为________反应。
(6)已知:  。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成
。以1,3-丁二烯为起始原料,结合已知信息选用必要的无机试剂合成![]() 。将以下合成路线补充完整:_________________
。将以下合成路线补充完整:_________________

(7)已知氨基(-NH2)与羟基类似,也能发生反应i。在由J制备K的过程中,常会产生副产物L。L分子式为C16H13NO3,含三个六元环,则L的结构简式为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡
时,下列说法正确的是( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的m/n倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m
查看答案和解析>>
科目: 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法

i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列热化学方程式书写正确的是:
A.2SO2+O2![]() 2SO3 ΔH=-196.6 kJ·mol-1
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+ ![]() O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应4A(s)+3B(g)![]() 2C(g)+D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
2C(g)+D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是
A.用A表示的反应速率是0.4 mol/(Lmin)
B.2 min内,v正(B)和v逆(C)表示的反应速率的值都是逐渐减小的
C.2 min末的反应速率用B表示是0.3 mol/(Lmin)
D.分别用B、C、D表示的反应速率其比值是3:2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】将CO2转化为甲醇的原理为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
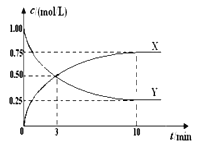
A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到10min时,H2的反应速率υ(H2)=0.225 mol/(L·min)
C. 500 ℃时该反应的平衡常数K=3
D. 平衡时H2 的转化率为75%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com