
科目: 来源: 题型:
 (2009?广东)下图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( ) (2009?广东)下图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是( )
|
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 11.82g |
| 197g/mol |
| 11.82g |
| 197g/mol |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:


 +3NaOH
+3NaOH| 水 |
 +NaBr+H2O
+NaBr+H2O +3NaOH
+3NaOH| 水 |
 +NaBr+H2O
+NaBr+H2O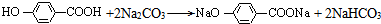
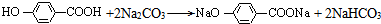
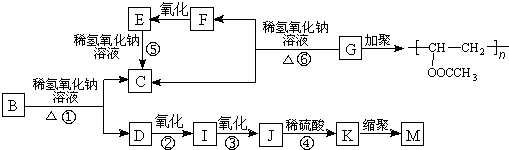
查看答案和解析>>
科目: 来源: 题型:



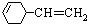



查看答案和解析>>
科目: 来源: 题型:阅读理解
| 浓硫酸 | 加热 |


查看答案和解析>>
科目: 来源: 题型:阅读理解
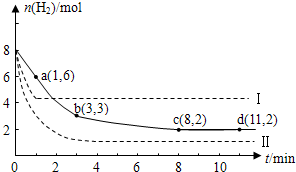 (2011?闵行区二模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
(2011?闵行区二模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:| [CH3OH]?[H2O] |
| [CO2]?[H2]3 |
| [CH3OH]?[H2O] |
| [CO2]?[H2]3 |
查看答案和解析>>
科目: 来源: 题型:
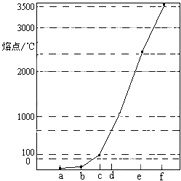 (2011?闵行区二模)如图是Na、Al、Si、H、C、N等元素某种常见单质的熔点高低的顺序,其中c、d均是热和电的良导体.
(2011?闵行区二模)如图是Na、Al、Si、H、C、N等元素某种常见单质的熔点高低的顺序,其中c、d均是热和电的良导体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com