
科目: 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
科目: 来源: 题型:
【题目】能源问题是人类社会面临的重大问题,合理的开发利用至关重要。
(1)丁烯是石油化工中的重要产物,正丁烷脱氢可制备1-丁烯:C4H10(g) =C4Hg(g) +H2(g) △H。 下表为该反应中所涉及物质的键能数据:
![]()
则△H=_______
(2)甲醇是未来重要的绿色能源之一,常见的合成反应为CO(g) +2H2(g)![]() CH3OH(g)H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
CH3OH(g)H<0;为了探究反应物的浓度对反应速率的影响,进行了相关实验,测得的实验数据如下表所示:
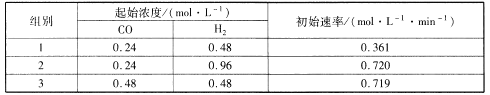
该反应速率的通式为v正=k正cm(CO).cn(H2)(k是与温度有关的速率常数)。由表中数据可确定反应速率通式中m和n分别_____、_____( 取正整数)。
(3)合成甲醇的原料气既可由煤气化提供,也可由天然气与水蒸气通过下列反应制备:CH4(g) + H2O(g) ![]() CO(g) +3H2(g)H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
CO(g) +3H2(g)H>0。向100 L刚性密闭容器中充人1 mol CH4和3 mol水蒸气进行反应,不同温度和压强下平衡体系中CH4的平衡转化率情况如图1所示:
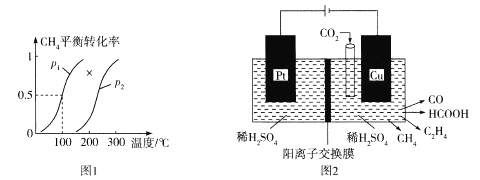
①p1____p2(填“<”“>”或“=")。
②已知压强为P1,温度为100°C时,反应达到平衡所需的时间为5min,则0~5min内用H2表示的平均反应速率为______;该温度下的平衡常数K=_______mol2·L-2。
(4)近年来,有人研究用温室气体二氧化碳通过电催化生成多种燃料,其工作原理如图2所示。
①写出Cu电极上产生乙烯的电极反应式:_____________;如果Cu电极上生成0.17molCO和0.33molHCOOH,则Pt电极上产生O2的物质的量为__________mol。
②HCOOH为一元弱酸,常温下将0.1mol·L-1HCOOH溶液与0.1mol·L-1NaOH溶液按体积比a:b混合(忽略溶液体积的变化),混合后溶液恰好显中性,则HCOOH的电离常数为______(用含a、b的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】最近一个科学硏究小组创建了一种通过连续电解将能量储存为化学能的装置。在氧化钇基质的阳极和二氧化钛涂覆的钛阴极之间是可通过H+的固体聚合物电解质。其结构如图所示,则下列说法错误的是
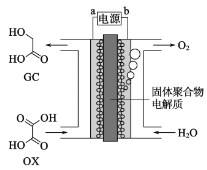
A.电源的b极为正极
B.在能量转换过程中,固体电解质中H+由阳极向阴极移动
C.阴极电极反应式为:OX+4H++4e-=GC+H2O
D.为增强阳极电解液导电性,可在水中添加适量盐酸或NaCl
查看答案和解析>>
科目: 来源: 题型:
【题目】以苯为原料合成F,转化关系如下:

F是一种具有重要工业价值的芳香化合物,含有C、H、O、N四种元素,其蒸气密度是相同状况下氢气密度的74.5倍,分子中有两个互为对位的取代基。C能与碳酸氢钠溶液反应,试剂②为Fe/HCl。
已知:①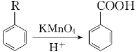 ;
;
②![]() (苯胺:弱碱性,易被氧化)
(苯胺:弱碱性,易被氧化)
③RCOCl![]() RCOR’
RCOR’
请回答下列问题:
(1)反应①为加成反应,写出A的化学式:_____________。
(2)B中所含官能团的名称为________;生成B时,常伴有副反应发生,反应所得产物除B外可能还含有____________________(写出一种产物的结构简式)。
(3)试剂①是_____________;试剂①和试剂②的顺序能否互换:________(填“能”或“不能”);为什么?_________________________________________________________。
(4)E生成F的化学方程式为__________________________________________________。
(5)参照上述合成路线,以(CH3)2CHCHO和CH3MgCl为原料(无机试剂任选),设计制备(CH3)2CHCOCH3的合成路线____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图),下列说法错误的是( )

A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行,该反应的离子方程式为:Fe2++2HCO3-= FeCO3+ CO2↑+H2O
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
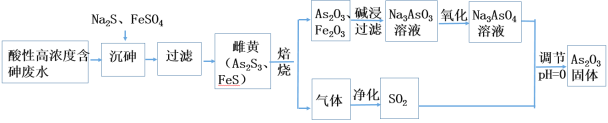
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
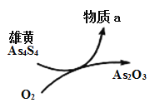
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
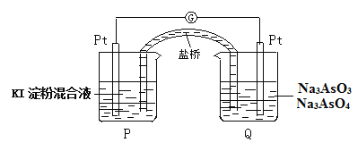
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如下图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。
提示:实验室中所用的少量氯气可以用下述原理制取:

2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
(1)氧化剂与还原剂物质的量之比为____________ ,氧化产物为____________。
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是(工业上用此原理制取漂白粉。)______________________,
(4)b处离子方程式是_______________________________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4 用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:__________________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式:
_____MnO4-+______H2C2O4+______ H+=____Mn2++_____CO2↑+_____ ________
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_______。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是____________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。
注意事项:
1、本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。
2、密封保存,请勿与洁厕灵同时使用。
3、保质期为一年。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为_________________________。
(2)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。
在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为__________________
,其离子方程式为__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是_________________________(用化学方程式表示)。
(2)已知:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(g) △H1=-5316 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746 kJ·mol-1
①若H2O(l)=H2O(g) △H=+44 kJ·mol-1,则表示正丁烷燃烧热的热化学方程式为__________________。
②部分化学键键能数据为:氧分子中氧氧键的键能为494 kJ·mol-1;C=O的键能为799 kJ·mol-1;CO分子中碳氧键的键能为1076 kJ·mol-1;请计算出反应2CO(g)+O2(g)=2CO2(g)的△H=______________kJ·mol-1,由此可以计算△H2=__________kJ·mol-1
(3)1573K时,N2+O2![]() 2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为_____________mol,N2的转化率为____________。
2NO平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为_____________mol,N2的转化率为____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)=NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)=NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A.反应速率与NO2浓度有关 B.反应速率与NO浓度有关
C.反应的中间产物只有NO3 D.第一步反应活化能较低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com