
科目: 来源: 题型:
【题目】氮化铝(AlN)陶瓷是一种新型无机非金属材料, 最高可稳定到2473K, 导热性好、热膨胀系数小,是良好的耐热冲击材料。制取原理为:Al2O3+3C+N2![]() 2A1N+3CO,回答下列问题:
2A1N+3CO,回答下列问题:
(1)氮化铝的晶体类型为________。在上述化学方程式中第二周期元素的第一电离能由小到大的顺序是______。
(2)基态氧原子电子占据最高能级的原子轨道的形状是________,未成对电子数为________。
(3)等电子体具有相似的结构。CO与N2互为等电子体,CO分子中σ键与π键数目之比为_______。
(4)Cu2+处于:[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化________(填“是”或“否”)理由为_________。
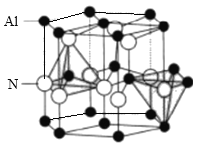
(5)AlN晶体结构如图所示,1个Al原子周围距离最近的Al原子数为______个;若晶胞结构的高为a nm, 底边长为b nm,NA表示阿伏伽德罗常数的值,则其密度为_______g.cm-3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目: 来源: 题型:
【题目】下列曲线中,可以描述乙酸(甲, Ka=1.8×10-5)和一氯乙酸(乙, Ka=1.4×10-3)在水中的电离度与浓度关系的是()

A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】CO、CO2是化石燃料燃烧后的主要产物。
(1)将体积比为2:1的CO2和CO混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃。将残留固体溶于水,所得溶液中2c(CO32-)+c(HCO3-)____________c(Na+)(填“>”“<”或“=”) 。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ/mol;键能E(o=o)=499.0 kJ/mol
①CO(g)+O2(g)![]() CO2(g)+O(g) 的△H=____________kJ/mol
CO2(g)+O(g) 的△H=____________kJ/mol
②已知2500K时,①中反应的平衡常数为0.40。某时刻该反应体系中各物质浓度满足: c(CO)·c(O2)=c(CO2)·c(O),则此时反应____________(填向左”或“向右”)进行。
(3)已知:反应CO2(g)![]() CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)
CO(g)+O(g)在密闭容器中CO2分解实验的结果如下图1;反应2CO2(g)![]() 2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2,
2CO(g)+O2(g)中1molCO2在不同温度下的平衡分解量如下图2, 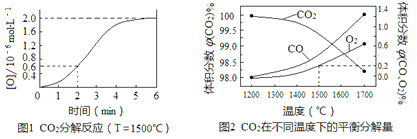
①分析图1,求2min内v(CO2)=_______。
②分析图2,1500℃时反应达平衡,此时容器体积为1 L,则反应的平衡常数K=______(计算结果保留1位小数)。
(4)为探究不同催化剂对CO和H2合成CH3OH的选择性效果,某实验室控制CO和H2的初始投料比为1:3进行实验,得到如下数据:
选项 | T/K | 时间/min | 催化剂种类 | 甲醇的含量(%) |
A | 450 | 10 | CuO-ZnO | 78 |
B | 450 | 10 | CuO-ZnO-ZrO2 | 88 |
C | 450 | 10 | ZnO-ZrO2 | 46 |
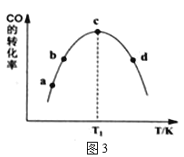
①由表1可知,该反应的最佳催化剂为____________(填编号);图3中a、b、c、d四点是该温度下CO的平衡转化率的是____________。
②有利于提高CO转化为CH3OH的平衡转化率的措施有____________。
A. 使用催化剂CuO-ZnO-ZrO2 B. 适当降低反应温度
C. 增大CO和H2的初始投料比 D. 恒容下,再充入a mol CO和3a mol H2
查看答案和解析>>
科目: 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目: 来源: 题型:
【题目】从物质A(某正盐)的水溶液出发有下面所示的一系列变化:
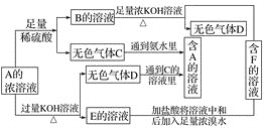
(1)写出A~F物质的化学式:
A__________;B__________;C__________;D__________;E.__________;F__________。
(2)写出E→F的化学方程式______________________________。
(3)鉴别物质F中阴离子的方法是________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废水(镍主要以NiR2络合物形式存在)制取草酸镍(NiC2O4),再高温灼烧草酸镍制取三氧化二镍。工艺流程如图所示:

已知:①NiR2(aq)![]() Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
②Ksp[Fe(OH)3] =2.16×10-39, Ksp[Ni(OH)2] =2×10-15
③Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=5.4×10-5
④“脱络”过程中,R-与中间产物·OH反应生成·R(有机物自由基),·OH能与H2O2发生反应。有关反应的方程式如下:
i.Fe2++H2O2=Fe3++OH-+·OH.
ii.R-+·OH=OH-+·R
iii.H2O2+2OH=O2↑+2H2O
请回答下列问题:
(1)中间产物·OH的电子式是_______。
(2)“沉铁”时,若溶液中c(Ni2+)=0.01 mol/L,加入碳酸钠调溶液的pH为______(假设溶液体积不变,1g6≈0.8)使Fe 3+恰好沉淀完全(离子的浓度≤1.0×10-5 mol/L),此时_____(填“有”或“无”)Ni(OH)2沉淀生成。
(3)25℃时pH=3的草酸溶液中 =____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
=____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
(4)加入Fe2+和H2O2能够实现“脱络”的原因是____________。
(5)工业上还可用电解NiCl2等混合溶液的方法制取三氧化二镍。电解过程中ClO-把Ni(OH)2氧化为三氧化二镍。写出该反应的离子方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
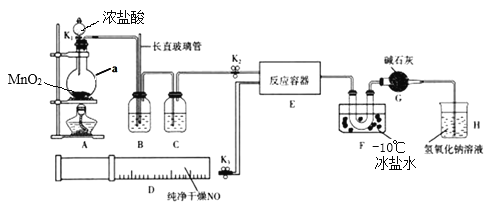
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂, 可由NO与Cl2在通常条件下反应得到。某学习小组在实验室用如图所示装置制备NOCl。
已知:亚硝酰氯(NOCl)的熔点为-64.5℃、沸点为-5.5℃, 气态呈黄色,液态时呈红褐色,易与水反应。
请回答下列问题:
(1)装置A中仪器a的名称是____________。
(2)实验开始时,应先打开K2,再打开____________(填K1”或K3”),通入一段时间气体,其目的是____________。
(3)实验时利用装置B除去某些杂质气体并通过观察B中的气泡来判断反应速率,装置B中的长直玻璃管还具有的作用是____________。
(4)装置C中应选用的试剂为____________(填试剂名称)。
(5)装置F的作用是____________。
(6)工业上可用间接电化学法除去NO,其原理如图所示,吸收塔中发生的反应为:NO+S2O42-+H 2O——N2+HSO3-(未配平)
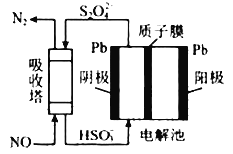
①吸收塔内发生反应的氧化剂与还原剂物质的量之比为________。
②阴极的电极反应式为_______。
(7)NOCl与H2O反应生成HNO2和HCl。请设计实验证明HNO2是弱酸:_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
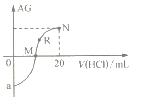
A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目: 来源: 题型:
【题目】我国历史悠久,有灿烂的青铜文明,出土大量的青铜器。研究青铜器中(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )
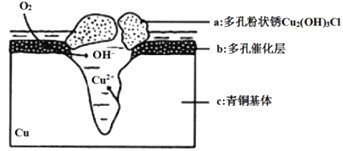
A.青铜器发生电化学腐蚀,图中c作负极,被氧化
B.正极发生的电极反应为O2+4e-+2H2O=4OH-
C.环境中的C1-与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
D.若生成2 mol Cu2(OH)3Cl, 则理论上消耗标准状况下O2的体积为22.4 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com