
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废水(镍主要以NiR2络合物形式存在)制取草酸镍(NiC2O4),再高温灼烧草酸镍制取三氧化二镍。工艺流程如图所示:

已知:①NiR2(aq)![]() Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
②Ksp[Fe(OH)3] =2.16×10-39, Ksp[Ni(OH)2] =2×10-15
③Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=5.4×10-5
④“脱络”过程中,R-与中间产物·OH反应生成·R(有机物自由基),·OH能与H2O2发生反应。有关反应的方程式如下:
i.Fe2++H2O2=Fe3++OH-+·OH.
ii.R-+·OH=OH-+·R
iii.H2O2+2OH=O2↑+2H2O
请回答下列问题:
(1)中间产物·OH的电子式是_______。
(2)“沉铁”时,若溶液中c(Ni2+)=0.01 mol/L,加入碳酸钠调溶液的pH为______(假设溶液体积不变,1g6≈0.8)使Fe 3+恰好沉淀完全(离子的浓度≤1.0×10-5 mol/L),此时_____(填“有”或“无”)Ni(OH)2沉淀生成。
(3)25℃时pH=3的草酸溶液中 =____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
=____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
(4)加入Fe2+和H2O2能够实现“脱络”的原因是____________。
(5)工业上还可用电解NiCl2等混合溶液的方法制取三氧化二镍。电解过程中ClO-把Ni(OH)2氧化为三氧化二镍。写出该反应的离子方程式:____________。
【答案】![]() 2.8 无 3.02 Ni2++H2C2O4=NiC2O4↓+2H+ Fe2+和H2O2发生反应产生·OH,·OH将R-转化为·R,c(R-)减小,使平衡NiR2(aq)
2.8 无 3.02 Ni2++H2C2O4=NiC2O4↓+2H+ Fe2+和H2O2发生反应产生·OH,·OH将R-转化为·R,c(R-)减小,使平衡NiR2(aq)![]() Ni2+(aq)+2R-(aq)向正反应方向移动,实现“脱络” ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O
Ni2+(aq)+2R-(aq)向正反应方向移动,实现“脱络” ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O
【解析】
Fe2+与H2O2反应产生中间产物OH、Fe3+、OH-,含镍废水NiR2在“脱络”过程中R-与中间产物OH反应产生R和OH-,然后向溶液中加入Na2CO3,发生盐的双水解反应产生Fe(OH)3沉淀和CO2气体,过滤后向滤液中价态草酸,发生反应产生NiC2O4沉淀,然后灼烧NiC2O4与O2反应产生Ni2O3、CO2气体。
(1)中间产物OH由氧原子与氢原子之间形成一对共用电子对,电子式为:![]() ;
;
(2)“沉铁”时,铁离子沉淀完全,根据Ksp[Fe(OH)3]=c(Fe3+)c3(OH-)=2.16×10-39,则c(OH-)=![]() mol/L=6×10-12 mol/L,故c(H+)=
mol/L=6×10-12 mol/L,故c(H+)=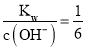 ×10-2 mol/L,所以此时pH=-lg c(H+)=2+lg6=2.8;溶液中c(Ni2+)=0.01 mol/L,则Qc[Ni(OH)2]=0.01 mol/L×(6×10-12 mol/L)2<Ksp[Ni(OH)2]=2×10-15,因此此时无Ni(OH)2沉淀生成;
×10-2 mol/L,所以此时pH=-lg c(H+)=2+lg6=2.8;溶液中c(Ni2+)=0.01 mol/L,则Qc[Ni(OH)2]=0.01 mol/L×(6×10-12 mol/L)2<Ksp[Ni(OH)2]=2×10-15,因此此时无Ni(OH)2沉淀生成;
(3)25℃时,pH=3的草酸溶液中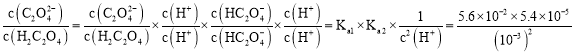 =3.02;“沉镍”即镍离子与草酸得到草酸镍沉淀,离子方程式为:Ni2++H2C2O4=NiC2O4↓+2H+;
=3.02;“沉镍”即镍离子与草酸得到草酸镍沉淀,离子方程式为:Ni2++H2C2O4=NiC2O4↓+2H+;
(4)加入Fe2+和H2O2能够实现“脱络”的原因是是Fe2+和H2O2发生反应生成OH,OH将R-转化为R,c(R-)减小,使平衡使平衡NiR2(aq)![]() Ni2+(aq)+2R-(aq)向正反应方向移动,实现“脱络”;
Ni2+(aq)+2R-(aq)向正反应方向移动,实现“脱络”;
(5)工业上还可用电解NiCl2等混合溶液的方法制取三氧化二镍。电解过程中ClO-把Ni(OH)2氧化为Ni2O3,ClO-被还原产生Cl-。根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为:ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O。


科目:高中化学 来源: 题型:
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
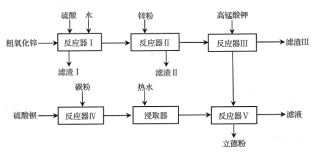
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
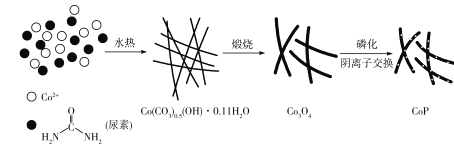
(1)基态P原子的电子排布式为___。P在元素周期表中位于___区。
(2)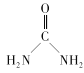 中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
(3)CO32-中C的价层电子对数为___,其空间构型为___。
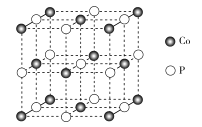
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加德罗常数的值, 则其晶胞密度为___g.cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应原理可以应用在生产上,如用于焊接钢轨等,实验室铝热反应的实验装置如图所示。
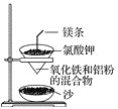
(1)镁条的作用是___。
(2)写出该反应的化学方程式:___;在冶金工业上也常用这一反应原理来冶炼__(填字母)。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(3)为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
①若取ag样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为bL。反应的离子方程式是___;样品中铝的质量为___g。
②另取ag样品将其点燃,恰好完全反应,反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与(1)中所得气体的体积比c∶b=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,11.2 L SO2含有的氧原子数小于NA
B.0. 1 mol Na2O2和Na2O的混合物中含有的离子总数等于0.4NA
C.10 g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D.100 mL 0.1 mol/L醋酸中含有的醋酸分子数是0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在容积为2 L的密闭容器中发生反应2X(g)+Y(g)![]() 2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
2W(g) ΔH<0,当充入2 mol X和1 mol Y,经20 s达到平衡时生成了0.4 mol W。下列说法正确的是( )
①升高温度,W的体积分数减小,ΔH增大 ②以Y的浓度变化表示的反应速率为0.01 mol·L-1·s-1 ③在其他条件不变的情况下,增加1 mol X,则X和Y的转化率均提高 ④增大压强,正反应速率增大,逆反应速率减小,则平衡向正反应方向移动 ⑤再向容器中通入2 mol X和1 mol Y,达到平衡时,X、Y的转化率均增大
A. ⑤ B. ①⑤ C. ②③④ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为MnO2+Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。

(1)Mn2+的核外电子排布式为__;有机高聚物中C的杂化方式为__。
(2)已知CN-与N2互为等电子体,推算拟卤素(CN)2分子中σ键与π键数目之比为__。
(3)NO2-的空间构型为__。
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

Mn的第一电离能是__,O2的键能是__,MnO的晶格能是__。
(5)R(晶胞结构如图)由Zn、S组成,其化学式为__(用元素符号表示)。已知其晶胞边长为a cm,则该晶胞的密度为__g·cm-3(阿伏加德罗常数用NA表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com