
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为MnO2+Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。
ZnSO4[Zn(OH)2]·xH2O,其电池结构如图甲所示,图乙是有机高聚物的结构片段。

(1)Mn2+的核外电子排布式为__;有机高聚物中C的杂化方式为__。
(2)已知CN-与N2互为等电子体,推算拟卤素(CN)2分子中σ键与π键数目之比为__。
(3)NO2-的空间构型为__。
(4)MnO是离子晶体,其晶格能可通过如图的Born-Haber循环计算得到。

Mn的第一电离能是__,O2的键能是__,MnO的晶格能是__。
(5)R(晶胞结构如图)由Zn、S组成,其化学式为__(用元素符号表示)。已知其晶胞边长为a cm,则该晶胞的密度为__g·cm-3(阿伏加德罗常数用NA表示)。

【答案】1s22s22p63s23p63d5 sp2、sp3 3:4 V形 b kJ·mol-1 2e kJ·mol-1 (f-a-b-c-d-e) kJ·mol-1 ZnS ![]()
【解析】
(1)锰原子的电子排布式为1s22s22p63s23p63d54s2,由此可确定Mn2+的核外电子排布式;有机高聚物中C的价层电子对数分别为3和4,由此可得出杂化方式;
(2)已知CN-与N2互为等电子体,可推出拟卤素(CN)2分子结构为N≡C-C≡N,由此可推出σ键与π键数目之比;
(3)NO2-的价层电子对数为![]() =3,由此可确定空间构型;
=3,由此可确定空间构型;
(4)Mn的第一电离能是指由Mn(g)→Mn+时吸收的能量,O2的键能是指破坏1mol O2分子内 共价键所需吸收的能量,MnO的晶格能可利用盖斯定律求出;
(5)R(晶胞结构如图)由Zn、S组成,利用均摊法,可求出晶胞中所含有的Zn、S原子数,从而确定其化学式。已知其晶胞边长为a cm,可求出1个晶胞的体积和质量,从而求出该晶胞的密度;
(1)锰原子的电子排布式为1s22s22p63s23p63d54s2,则Mn2+的核外电子排布式为1s22s22p63s23p63d5;有机高聚物中C的价层电子对数分别为3和4,则杂化方式分别为sp2、sp3;答案:1s22s22p63s23p63d5;sp2、sp3;
(2)已知CN-与N2互为等电子体,可推出拟卤素(CN)2分子结构为N≡C-C≡N,则σ键为3个,π键为4个,从而得出σ键和π键为数目之比为3:4;答案为:3:4;
(3)NO2-的价层电子对数为![]() =3,N与2个O各形成共价双键,另有一对孤对电子,对成键电子有排斥作用,从而使结构不对称,由此可确定空间构型为V形;答案为:V形;
=3,N与2个O各形成共价双键,另有一对孤对电子,对成键电子有排斥作用,从而使结构不对称,由此可确定空间构型为V形;答案为:V形;
(4)由图中可知,Mn(g)→Mn+时吸收的能量为b kJ·mol-1,则Mn的第一电离能为b kJ·mol-1;键能是指破坏1mol O2分子内共价键所需吸收的能量,由图中可确定O2的键能是2e kJ·mol-1;MnO的晶格能可利用盖斯定律,按箭头所指方向,MnO的晶格能为(f-a-b-c-d-e) kJ·mol-1;答案为:b kJ·mol-1;2e kJ·mol-1;(f-a-b-c-d-e) kJ·mol-1;
(5)R(晶胞结构如图)由Zn、S组成,利用均摊法,可求出晶胞中所含有的Zn、S原子数分别为4,从而确定其化学式为ZnS;已知其晶胞边长为a cm,可求出1个晶胞的体积和质量,从而求出该晶胞的密度为![]() =
=![]() g·cm-3;答案为:
g·cm-3;答案为:![]() 。
。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废水(镍主要以NiR2络合物形式存在)制取草酸镍(NiC2O4),再高温灼烧草酸镍制取三氧化二镍。工艺流程如图所示:

已知:①NiR2(aq)![]() Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
Ni2+(aq)+2R-(aq)(R-为有机物配位体,K=1.6×10-14)
②Ksp[Fe(OH)3] =2.16×10-39, Ksp[Ni(OH)2] =2×10-15
③Ka1(H2C2O4)=5.6×10-2,Ka2(H2C2O4)=5.4×10-5
④“脱络”过程中,R-与中间产物·OH反应生成·R(有机物自由基),·OH能与H2O2发生反应。有关反应的方程式如下:
i.Fe2++H2O2=Fe3++OH-+·OH.
ii.R-+·OH=OH-+·R
iii.H2O2+2OH=O2↑+2H2O
请回答下列问题:
(1)中间产物·OH的电子式是_______。
(2)“沉铁”时,若溶液中c(Ni2+)=0.01 mol/L,加入碳酸钠调溶液的pH为______(假设溶液体积不变,1g6≈0.8)使Fe 3+恰好沉淀完全(离子的浓度≤1.0×10-5 mol/L),此时_____(填“有”或“无”)Ni(OH)2沉淀生成。
(3)25℃时pH=3的草酸溶液中 =____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
=____________(保留两位小数)。“沉镍”即得到草酸镍沉淀,其离子方程式是____________。
(4)加入Fe2+和H2O2能够实现“脱络”的原因是____________。
(5)工业上还可用电解NiCl2等混合溶液的方法制取三氧化二镍。电解过程中ClO-把Ni(OH)2氧化为三氧化二镍。写出该反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO![]() +2H+===Cr2O
+2H+===Cr2O![]() +H2O Ba2++CrO
+H2O Ba2++CrO![]() ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的防腐剂。某化学兴趣小组设计如图所示装置(省略夹持装置)制备NaNO2并探究其性质。
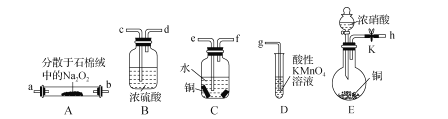
已知:①2NO+Na2O2=2NaNO2;
②NaNO2易被空气氧化,NO能被酸性高锰酸钾溶液氧化为NO3-;
③HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO+H2O。
回答下列问题:
(1)装置E中盛放铜片的仪器名称是_____,检査装置E气密性的方法是_____。
(2)上述实验装置中,依次连接的合理顺序为h-_____。
(3)装置D中酸性KMnO4溶液的作用是_____(用离子方程式表示)。
(4)反应结束后,取适量产品溶于稀硫酸中,观察到的实验现象为_____。
(5)测定深水井中亚硝酸钠含量:取1000mL水样于锥形瓶中,立即加入50.00mL0.001mol/L酸性高锰酸钾溶液,充分反应后用0.001mol·L-1草酸钠溶液滴定剩余的高锰酸钾,终点时消耗草酸钠溶液115.00mL。则水中NaNO2的含量为_____mg·L-1。若所取样品在空气中放置时间过长,则测定结果_____(填“偏高”“偏低”或“无影响”)。
有关反应如下:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;5C2O42-+2MnO4-+16H+=2Mn2++10CO2↑+8H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A.0.1 mol·L-1NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-)
B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化台物肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,其球棍模型如图所示(图中球与球之间的棍代表化学键,如单键、双键等)。其制备过程涉及肉桂醇电解制备肉桂醛,肉桂醛氧化制备肉非酸,再与甲醇酯化制得。下列说法不正确的是

A. 肉桂酸甲酯的分子式为C10H10O2
B. 电解肉桂醇制得的肉桂醛在电解池的阴极生成
C. 1mol肉桂酸甲酯与H2加成最多消耗4mol
D. 肉桂酸甲酯中所有碳原子可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定硼形科学的方法为_________________________________。
(2)下列B原子基态的价层电子排布图中正确的是___________
A.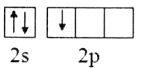 B.
B.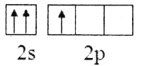
C.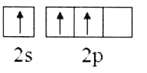 D.
D.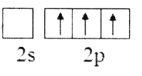
(3)NaBH4是重要的储氢载体,阴离子的立体构型为___________。
(4)三硫化四磷分子(结构如下图1所示)是___________分子(填极性”或非极性)。
(5)图2表示多硼酸根离子的一种无限长的链式结构,其化学式可表示为___________。
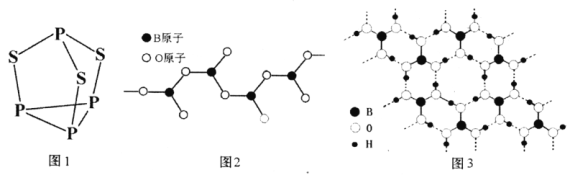
(6)硼酸晶体是片层结构,其中一层的结构如图3所示。硼酸在冷水中溶解度很小,但在热水中较大,原因是_________________________________。
(7)立方氮化硼(BN)是新型高强度耐磨材料,可作为金属表面的保护层,其晶胞结构(如右图)与金刚石类似。已知该晶体密度为ag/cm3,则晶体中两个N原子间的最小距离为___________pm。(用含a的代数式表示,NA表示阿伏加德罗常数)
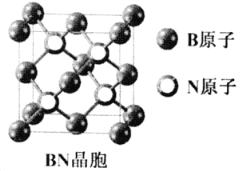
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种药物合成的中间体,F的一种合成路线如下:

已知:

回答下列问题:
(1)![]() 的名称为____。
的名称为____。
(2)D中含氧官能团的名称为____。
(3)B→C的反应方程式为____。
(4)D→E的反应类型为____。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____。
(6)依他尼酸钠( )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以![]() 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁防腐方法有许多种,如图是其中的一种方法,描述正确的是( )
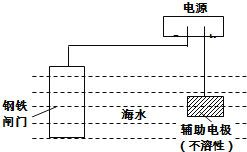
A.如图所示是牺牲阳极的阴极保护法
B.铁闸门作阴极,发生还原反应
C.电子流向:a→铁闸门,辅助电极→b
D.辅助电极上的反应:O2+2H2O+4e=4OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com