
科目: 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v (N2)=0.2molL﹣1min﹣1B.v (N2)=5molL﹣1s﹣1
C.v (NH3)=0.1molL﹣1min﹣1D.v (H2)=0.3molL﹣1min﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是

①C、CO ②S、SO2 ③Na、Na2O ④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A. ①④⑤ B. ①②③ C. ①③④ D. ①③④⑤⑥
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列叙述错误的是
A.7.8gNa2O2与过量水反应转移电子数为0.1NA
B.1 mol OD-离子含有的质子、中子数均为9NA
C.46g NO2和N2O4混合气体中含有原子总数为3NA
D.已知N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ·mol﹣1,当有3NA个电子转移时,△H变为﹣46.2kJ·mol﹣1
2NH3(g)△H=﹣92.4kJ·mol﹣1,当有3NA个电子转移时,△H变为﹣46.2kJ·mol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.室温时,Ka=1×10-5浓度为0.1mol/L的HA溶液,pH=3
B.将pH=2的HCl溶液和pH=4的H2SO4溶液等体积混合,所得溶液pH=3
C.0.1 mol/L氨水和0.1 mol/L NH4Cl溶液等体积混合后所得溶液pH>7,则c(NH4+) < c(NH3·H2O)
D.向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液反应的离子方程式为:HA-+ OH- = H2O + A2-
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵晶体![]() 又称摩尔盐,
又称摩尔盐,![]() ,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、
,浅绿色能溶于水,在空气中不易被氧化。实验室以废铁屑(含少量硫化物、![]() 、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
、油污等杂质)为料制备硫酸亚铁铵晶体的流程如下:
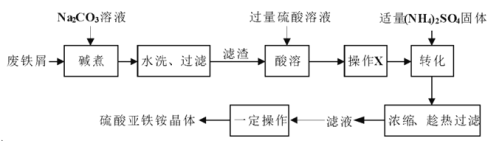
回答下列问题:
(1)“碱煮”的目的是___________。
(2)“酸溶”在如图所示装置中完成(部分装置省略)。仪器![]() 的名称是______,反应过程中有臭鸡蛋气味气体产生,则装置
的名称是______,反应过程中有臭鸡蛋气味气体产生,则装置![]() 的作用是_____________________。
的作用是_____________________。
(3)欲检测“酸溶”所得溶液中是否含有![]() ,可选用试剂为_____________,结果表明溶液中不含
,可选用试剂为_____________,结果表明溶液中不含![]() ,原因是______________________。“操作
,原因是______________________。“操作![]() ”是加入铁粉,指出该操作的主要目的是________________。
”是加入铁粉,指出该操作的主要目的是________________。
(4)产品纯度测定:称取![]() 硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成
硫酸亚铁铵晶体样品,加入硫酸溶解,用容量瓶配制成![]() 溶液。量取
溶液。量取![]() 所配溶液于锥形瓶中,消耗
所配溶液于锥形瓶中,消耗![]() 酸性
酸性![]() 标准溶液体积为
标准溶液体积为![]() 。
。
①滴定过程反应的离子方程式为_____________。
②产品的纯度为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。工业ZnO中含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ),纯化工业ZnO的流程如下:

提示:在本实验条件下,Ni(Ⅱ)不能被氧化。
(1)“酸浸”时需不断通入髙温水蒸气,其目的是 ________________。
(2)“除杂I”中生成Fe(OH)3反应的离子方程式为______________________________。
(3)“除杂2”中所得滤渣主要成分是____________。
(4)滤饼要用水洗,检验是否洗涤干净的方法是_________________。
(5)已知:Zn(OH)2 的 Ksp=l×10-17。室温下为使Zn2+完全沉淀(其浓度<1×10-5mol·L-1),需调节溶液pH范围为____________。
查看答案和解析>>
科目: 来源: 题型:
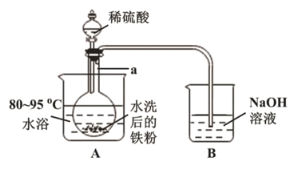
【题目】氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如图实验制备卤砂并进行元素测定。
Ⅰ.实验室制备卤砂所需的装置如图所示,装置可重复选用。

(1)装置接口连接顺序是___→a;b←___。
(2)C装置的作用是___,D装置盛装的物质是___。
(3)写出用上述装置制备氨气的一组试剂:___。
Ⅱ.测定卤砂中Cl元素和N元素的质量之比。
该研究小组准确称取ag卤砂,与足量氧化铜混合加热,充分反应后把气体产物按如图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为VL,碱石灰增重bg。

(4)E装置内的试剂为___,卤砂与氧化铜混合加热反应的化学方程式为___。
(5)卤砂中Cl元素和N元素的质量之比为___(用含b、V的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将ag卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物F是一种药物合成的中间体,F的一种合成路线如下:

已知:

回答下列问题:
(1)![]() 的名称为____。
的名称为____。
(2)D中含氧官能团的名称为____。
(3)B→C的反应方程式为____。
(4)D→E的反应类型为____。
(5)C的同分异构体有多种,其中苯环上连有—ONa、2个—CH3的同分异构体还有____种,写出核磁共振氢谱为3组峰,峰面积之比为6:2:1的同分异构体的结构简式____。
(6)依他尼酸钠( )是一种高效利尿药物,参考以上合成路线中的相关信息,设计以
)是一种高效利尿药物,参考以上合成路线中的相关信息,设计以![]() 为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
为原料(其他原料自选)合成依他尼酸钠的合成路线。________________
查看答案和解析>>
科目: 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源,开发新型储氢材料是氢能利用的重要研究方向。
Ⅰ.化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3
请回答下列问题:
(1)基态B原子的价电子排布式为___,B、C、N、O第一电离能由大到小的顺序为___,CH4、H2O、CO2的键角按照由大到小的顺序排列为___。
(2)与(HB=NH)3互为等电子体的有机分子为___(填分子式)。
Ⅱ.氢气的安全贮存和运输是氢能应用的关键。
(1)印度尼赫鲁先进科学研究中心的Datta和Pati等人借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种材料的分子呈平面结构(如图1),每个杂环平面上下两侧最多可吸附10个H2分子。
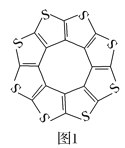
①C16S8分子中C原子和S原子的杂化轨道类型分别为___。
②相关键长数据如表所示:
化学键 | C—S | C=S | C16S8中碳硫键 |
键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S键与C=S键之间,原因可能是___。
③C16S8与H2微粒间的作用力是___。
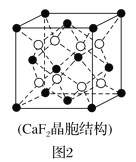
(2)具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子位于面心,Ag原子位于顶点,氢原子可进入到由Cu原子与Ag原子构成的四面体空隙中。若将Cu原子与Ag原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图2)相似,该晶体储氢后的化学式为___。
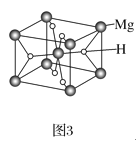
(3)MgH2是金属氢化物储氢材料,其晶胞如图3所示,已知该晶体的密度为ag·cm-3,则晶胞的体积为___cm3(用含a、NA的代数式表示,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在A、B两个恒容密闭容器中发生反应:2NO22NO +O2反应过程中NO2的物质的量随时间变化的状况如图所示:
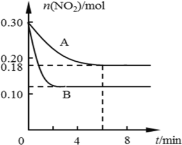
(1)若A容器的体积为5 L,反应经6 min达到平衡状态,则0~6 min内以O2浓度变化表示的反应速率为___________。
(2)该反应化学平衡常数K=__________(写出表达式)。
(3)说明该反应已达到平衡状态的是_______。
A.v正(NO2)=v逆(NO)B.c(NO2)=c(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
(4)若A、B两容器中只是温度不同,则TA____TB (填“>”或“<”),请写出一条能提高二氧化氮转化率的措施_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com