
科目: 来源: 题型:
【题目】有机物Y(乙酰氧基胡椒酚乙酸酯)具有抗氧化、抗肿瘤作用,可由化合物X在一定条件下合成,下列说法错误的是
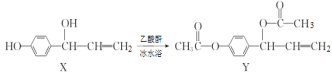
A.X转化成Y为取代反应
B.X、Y分子中含有的手性碳原子数不相同
C.1molX与溴水充分反应,最多消耗Br2的物质的量为3mol
D.1molY与NaOH溶液充分反应,最多消耗NaOH的物质的量为3mol
查看答案和解析>>
科目: 来源: 题型:
【题目】不能用勒夏特列原理解释的是( )
A.H2、I2(g)混合气体加压后颜色变深B.过量空气有利于SO2转化为SO3
C.向氯水中加石灰石可提高次氯酸的浓度D.光照新制氯水,氯水颜色变浅
查看答案和解析>>
科目: 来源: 题型:
【题目】钼(Mo)是一种重要的过渡金属元素,在电子行业有可能取代石墨烯,其化合物钼酸钠晶体(Na2MoO42H2O)可制造阻燃剂和无公害型冷水系统的金属抑制剂。由钼精矿(主要成分MoS2,含有少量不反应杂质)制备钼及钼酸钠晶体的工艺流程如下:

(1)焙烧时,下列措施有利于使钼精矿充分反应的是________(填序号)。
a 增大钼精矿的量 b 将矿石粉碎 c 采用逆流原理混合
(2)操作1的名称是______,“碱浸”过程中反应的离子方程式为________。
(3)经“蒸发结晶”过程可得到钼酸钠晶体的粗品,要得到纯净的钼酸钠晶体,需要进行的操作2名称是_________。
(4)Mo元素有+4、+6两种价态,钼精矿中存在非整比晶体MoS2.7,则MoS2.7中Mo4+所占Mo元素的物质的量分数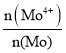 为__________。
为__________。
(5)焙烧钼精矿所用的装置是多层焙烧炉,如图为各炉层固体物料的物质的量的百分组成。图像中纵坐标x =_____。
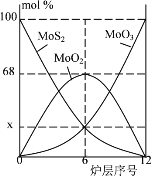
(6)在实际生产中会有少量SO42-生成,用固体Ba(OH)2除去。在除SO42-前测定碱浸液中c(MoO42-)=0.80mol·L-1, c(SO42-)=0.04mol·L-1,当BaMoO4开始沉淀时,SO42-的去除率为94.5%,则Ksp(BaMoO4)=_________。[ Ksp(BaSO4)= 1.1×10-10,溶液体积变化、温度变化可忽略。]
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,对于可逆反应N2(g)+3H2(g)![]() 2NH3(g),若N2、H2、NH3起始浓度分别为c1、c2、c3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是( )
2NH3(g),若N2、H2、NH3起始浓度分别为c1、c2、c3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是( )
A.c1:c2=3:1
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2和H2的转化率不相等
D.c1的取值范围为0mol·L-1<c1<0.14mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关叙述正确的是( )

A. 如上图所示是测定中和热的简易装置,大小两烧杯间填满碎泡沫塑料的作用是固定小烧杯
B. 若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL0.50 mol·L-1的硫酸充分反应,两反应测定的中和热不相等
C. 实验时需要记录初始温度T1和最高温度T2
D. 做一次实验根据公式即可得出中和反应的反应热
查看答案和解析>>
科目: 来源: 题型:
【题目】药物他莫肯芬(Tamoxifen)的一种合成路线如图所示:

已知:![]() +HBr
+HBr![]() +RBr
+RBr

回答下列问题。
(1)A+B→C的反应类型为__;C中官能团有醚键、__(填名称)。
(2)CH3CH2I的名称为__。
(3)反应D→E的化学方程式为__。
(4)Tamoxifen的结构简式为__。
(5)X是C的同分异构体。X在酸性条件下水解,生成2种核磁共振氢谱都显示4组峰的芳香族化合物,其中一种遇FeCl3溶液显紫色。X的结构简式为__、__(写2种)。
(6)设计用 和CH3I为原料(无机试剂任选)制备
和CH3I为原料(无机试剂任选)制备 的合成路线:__。
的合成路线:__。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯胺![]() 是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和NH3相似,与盐酸反应生成易溶于水的盐
和NH3相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理: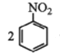 +3Sn+12HCl
+3Sn+12HCl![]()
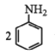 +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见下表:
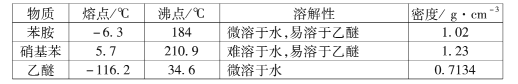
I.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。
Ⅱ.制备苯胺
往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。

(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。
Ⅲ.提取苯胺
i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。

ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。
(4)装置B无需用到温度计,理由是____。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。
(6)该实验中苯胺的产率为____。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫氰酸盐在化学工业中应用广泛。
(1)组成硫氰酸根(SCN -)的三种元素的部分性质见下表:
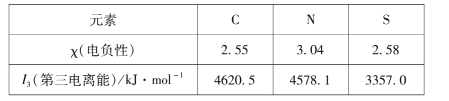
①硫氰酸根中碳元素的化合价为____。
②碳元素的I1、I2均比氮小。但I3却比氮高,其原因是____。
(2)晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d-d跃迁是金属阳离子在水溶液中显色的主要原因。下列硫氰酸盐的水溶液有颜色的是____(填标号)。
A KSCN B Fe(SCN)3 C Ni(SCN)2 D Zn(SCN)2
(3)NH4SCN广泛应用于医药、印染等行业,隔绝空气加热后可分解生成NH3、CS2、H2S、(CN)2及N2。
①SCN-可能具有[S-C≡N]-和____(填结构式)两种结构,中心原子碳的轨道杂化方式均为____。
②(CN)2熔沸点高于N2的原因是____。
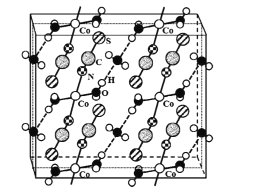
(4)硫氰酸钴可用于毒品检验。其水合物晶体的晶胞结构如下图所示(所有原子都不在晶胞的顶点或棱上)。
①晶体中微粒间作用力有____(填标号)。
A 金属键 B 氢键 C 非极性键 D 极性键 E 配位键
②晶体的化学式为____。
③硫氰酸钴晶体属于正交晶系,晶胞参数分别为a nm、b nm.c nm,α=β=γ=90°。晶体的摩尔质量为M g·mol-1。则晶体密度=____g·cm-3(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某CO催化加氢制甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2=+41.2kJ·mol-1
CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) ![]() CH3OH(g) △H3
CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa时,往某密闭容器中按投料比n(H2):n(CO2)=3:1充入H2和CO2。反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
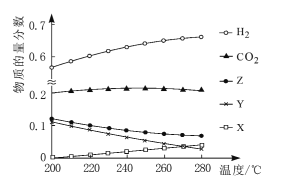
①体系中CO2的物质的量分数受温度的影响不大,原因是____。
②250℃时,反应ii的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中X、Y分别代表____(填化学式)。
(3)反应i可能的反应历程如下图所示。
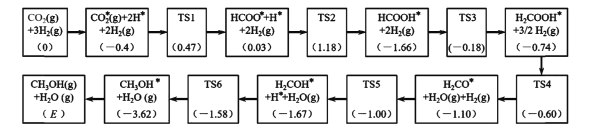
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为____。
②相对总能量E=____(计算结果保留2位小数)。(已知:leV=1.6×10-22kJ)
(4)用电解法也可实现CO2加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解池的____极通入氢气,阴极上的电极反应为____。
查看答案和解析>>
科目: 来源: 题型:
【题目】有反应4HCl(g)+O2(g)═2Cl2(g)+2H2O(g),已知2 mol O2被还原时,放出a kJ的热量,且知断开1 mol O=O键需要吸收b kJ的热量,断开1 mol Cl—Cl键需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl键所需能量高
A. (b-a-2c)/4kJB. (a+2b-4c)/8kJC. (a+b-2c)/4kJD. (2b-a-4c)/8kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com