
科目: 来源: 题型:

 Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解 Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解
Fe2++2OH-,当不断滴入EDTA时,EDTA将结合Fe2+,促使沉淀溶解平衡向右移动而溶解查看答案和解析>>
科目: 来源: 题型:
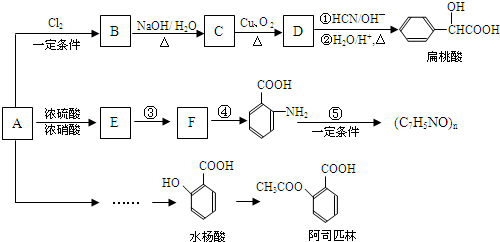
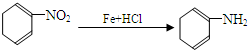 (苯胺,易被氧化)
(苯胺,易被氧化) (X为Cl或Br)
(X为Cl或Br)

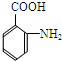
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O
| 一定条件 |
 +(n-1)H2O
+(n-1)H2O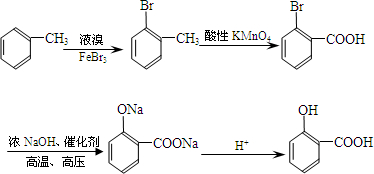


查看答案和解析>>
科目: 来源: 题型:
| 方法Ⅰ | 用硫和氮的氧化物之间的相互转化联合进行的脱硫和脱硝技术 |
| 方法Ⅱ | 用乙烯作为还原剂将氮的氧化物还原为N2的脱硝技术 |
| 方法Ⅲ | 用电化学原理将SO2转化为重要的化工原料H2SO4的脱硫技术 |

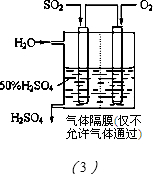
查看答案和解析>>
科目: 来源: 题型:
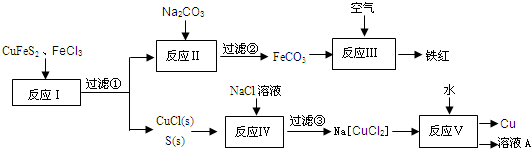
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:

| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解


| 实验步骤 | 实验现象 | 实验结论 |
| ① 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 取一根铂丝在火焰上灼烧至无色,再蘸取少许溶液X在火焰上烧 |
火焰呈黄色 火焰呈黄色 |
溶液X中含有钠离子 |
| ② 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) 取少许溶液X于一支试管中,先滴加硝酸,再滴加硝酸银溶液(或滴加硝酸酸化的硝酸银溶液) |
产生白色沉淀 产生白色沉淀 |
溶液X中含有氯离子 |
查看答案和解析>>
科目: 来源: 题型:
 如图1为甲烷和O2构成的燃料电池,电解质为KOH溶液,图2为电解
如图1为甲烷和O2构成的燃料电池,电解质为KOH溶液,图2为电解查看答案和解析>>
科目: 来源: 题型:
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com