
科目: 来源: 题型:







查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
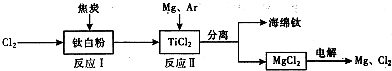
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:

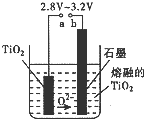
| 催化剂 |
| △ |
| 催化剂 |
| △ |
查看答案和解析>>
科目: 来源: 题型:
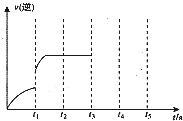 (2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.
(2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.| c(CO)?c(H2) |
| c(H2O) |
| 0.030 |
| t2-t1 |
| 0.030 |
| t2-t1 |
查看答案和解析>>
科目: 来源: 题型:
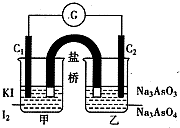 (2012?武汉模拟)已知反应“As
(2012?武汉模拟)已知反应“As| O | 3- 4 |
| O | 3- 3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中,CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.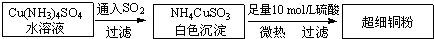
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com