
科目: 来源: 题型:
【题目】有机物A完全燃烧只生成CO2和H2O,将12g该有机物完全燃烧的产物通过足量浓硫酸,浓硫酸增重14.4g,再通过足量碱石灰,碱石灰增重26.4g,该有机物的分子式是( )
A.C4H10B.C3H8OC.C2H6OD.C2H4O2
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某有机物的结构简式为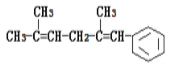 ,判断下列说法中不正确的是( )
,判断下列说法中不正确的是( )
A.它可以使酸性KMnO4溶液褪色
B.它可发生取代反应、加成反应、加聚反应、氧化反应
C.1mol该有机物燃烧消耗氧气为18.5mol
D.它与氢气发生加成反应,最多可以消耗4mol氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
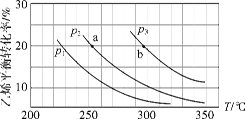
A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素 X、Y、Z、W 原子序数依次增大,Y 与 W 同族。X、Y、Z 三种原子最外层电子数的关系 为 X+Z=Y。电解 Z 与 W 形成的化合物的水溶液,产生 W 元素的气体单质,此气体同冷烧碱溶液作 用,可得到化合物 ZWX 的溶液。下列说法正确的是
A.W 的氢化物稳定性强于 Y 的氢化物
B.Z与其他三种元素分别形成的化合物中只含有离子键
C.Z 与 Y 形成的化合物的水溶液呈碱性
D.对应的简单离子半径大小为 W >Z > X>Y
查看答案和解析>>
科目: 来源: 题型:
【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下表中有关推论正确的是( )
已知事实 | 推论 | |
A | 氯乙烷能发生消去反应 | 所有的卤代烃都能发生消去反应 |
B | 乙烯分子内所有原子在同一平面上 | 丙烯分子内所有原子在同一平面上 |
C | 乙烯在空气中燃烧有黑烟 | 苯在空气中燃烧产生的烟更浓 |
D | 烷烃的含碳量随碳原子数的增大而增大 | 炔烃的含碳量随碳原子数的增大而增大 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数,下列说法正确的是
A.用氢氧燃料电池电解饱和食盐水得到 0.4mol NaOH,在燃料电池的负极上消耗氧气分子数为 0.1 NA
B.2 mol H3O+中含有的电子数为 20 NA
C.密闭容器中 1 mol N2(g)与 3 mol H2 (g)反应制备氨气,形成 6 NA 个 N-H 键
D.32 g N2H4中含有的共用电子对数为6 NA
查看答案和解析>>
科目: 来源: 题型:
【题目】聚乙二醇![]() )电解质散剂,常用于肠镜检查前的肠道清洁准备。下图是以具有 芳香气味的有机物A 为原料制取聚乙二醇的过程(部分产物已略去)。烃 C 中碳与氢元素的质量比为 6∶1,是同系物中最简单的物质;E 不能发生银镜反应。
)电解质散剂,常用于肠镜检查前的肠道清洁准备。下图是以具有 芳香气味的有机物A 为原料制取聚乙二醇的过程(部分产物已略去)。烃 C 中碳与氢元素的质量比为 6∶1,是同系物中最简单的物质;E 不能发生银镜反应。
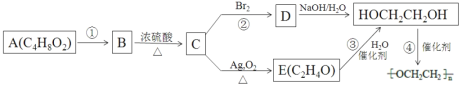
(1)E 物质的名称是_____。
(2)D 的键线式是_____。
(3)反应④的化学方程式是_____。
(4)下列说法正确的是_____。
a.A 在酸性或碱性条件下都可以反应得到B,反应②中的 Br2 可以是溴水或溴的 CCl4 溶液
b.工业上获得C 的的主要方法是催化裂化
c.可以用饱和碳酸钠溶液除去 B 中混有的少量A
d.反应①的反应类型为水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目: 来源: 题型:
【题目】在苹果、香蕉等水果的果香中存在着乙酸正丁酯。某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯。实验步骤如下:
(一)乙酸正丁酯的制备
①在50mL 圆底烧瓶中,加入0.15mol正丁醇和 0.12mol 冰醋酸,再加入3~4滴浓硫酸,摇匀,投入1~2粒沸石。按如图所示安装带分水器的回流反应装置, 并在分水器中预先加入水,使水面略低于分水器的支管口。
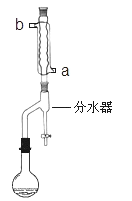
②打开冷凝水,圆底烧瓶在石棉网上用小火加热。在反应过程中,通过分水器下部的旋塞不断分出生成的水,注意保持分水器中水层液面原来的高度,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出的水的体积。
(二)产品的精制
③将分水器分出的酯层和反应液一起倒入分液漏斗中,用 10 mL 的水洗涤。有机层继续用10 mL10% Na2CO3 洗涤至中性,再用 10 mL 的水洗涤,最后将有机层转移至锥形瓶中,再用无水硫酸镁干燥。
④将干燥后的乙酸正丁酯滤入50 mL 烧瓶中,常压蒸馏,收集 124~126 ℃的馏分,得11.6g产品。
(1)冷水应该从冷凝管_____(填 a 或 b)管口通入。
(2)步骤②中不断从分水器下部分出生成的水的目的是_____。
(3)下列关于分液漏斗的使用叙述正确的是_____。
a.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞芯处不漏水即可使用
b.分液时乙酸正丁酯应从上口倒出
c.萃取振荡操作应如图所示![]()
d.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔
(4)该实验过程中,生成乙酸正丁酯(相对分子质量 116)的产率是_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
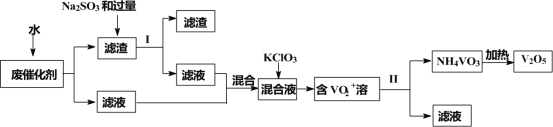
已知:①部分含钒物质常温下在水中的溶解性如表所示:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
②VO2++2OH-![]() VO3-+H2O
VO3-+H2O
回答下列问题:
(1)用水浸泡废催化剂,为了提高单位时间内废钒的浸出率,可以采取的措施为____________(写一条)。
(2)滤液1和滤液2中钒的存在形式相同,其存在形式为____________(填离子符号)。
(3)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应的化学方程式为____________。
(4)生成VO2+的反应中消耗1molKClO3时转移6mol电子,该反应的离子方程式为____________。
(5)在第Ⅱ步中需要加入氨水,请结合化学用语,用平衡移动原理解释加入氨水的一种作用为____________。
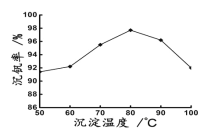
(6)最后钒以NH4VO3的形式沉淀出来。以沉钒率(NH4VO3沉淀中V的质量和废催化剂V的质量之比)表示该步反应钒的回收率。请结合如图解释在第Ⅱ步中温度超过80°C以后,沉钒率下降的可能原因是____________;____________(写两条)。
(7)该工艺流程中可以循环利用的物质为____________。
(8)测定产品中V2O5的纯度:
称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L1(NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+==VO2++Fe3++H2O)。最后用c2mol·L1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO4-被还原为Mn2+,假设杂质不参与反应。则产品中V2O5(摩尔质量:182g·mol1)的质量分数是____________。(列出计算式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com