
科目: 来源: 题型:
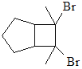
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①![]()
②![]()
回答下列问题:
(1)A的化学名称是______________________。
(2)由C生成D和E生成F的反应类型分别是_____________________、____________________。
(3)E的结构简式为______________________________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为______________________________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6:2:1:1,写出2种符合要求的X的结构简式:_______________。
(6)写出用环戊烷和2-丁炔为原料制备化合物的合成路线(其他试剂任选) _______________。
查看答案和解析>>
科目: 来源: 题型:
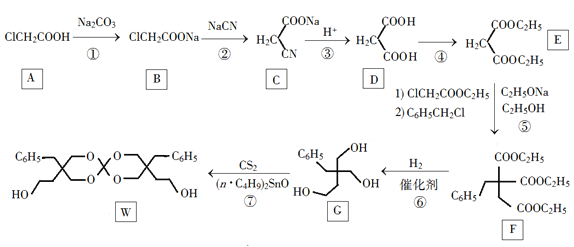
【题目】化合物W可用作高分子膨胀剂,一种合成路线如下:
回答下列问题:
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)反应④所需试剂,条件分别为________。
(4)G的分子式为________。
(5)W中含氧官能团的名称是____________。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。
(7)苯乙酸苄酯(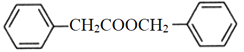 )是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
)是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线__________(无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】催化剂是化工技术的核心,绝大多数的化工生产需采用催化工艺。
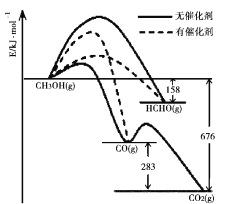
I.(1)催化剂的选择性指在能发生多种反应的反应系统中,同一催化剂促进不同反应的程度的比较,实质上是反应系统中目的反应与副反应之间反应速度竞争的表现。如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成____(选填“CO或CO2或HCHO”)。
(2)2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家哈德·埃特尔,他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。埃特尔研究的氮气和氢气分子在固体催化剂表面发生的部分变化过程如图所示:
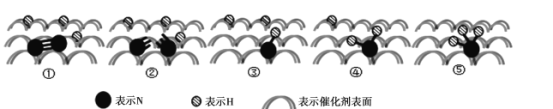
①下列说法不正确的是____。
A 升高温度可以提高一段时间内NH3的生产效率
B 图示中的②一③以及后面几个过程均是放热过程
C 此图示中存在H-H键断裂和N-N键断裂,以及N-H键的形成过程
②合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac(醋酸二氨合亚铜,Ac代表醋酸根)溶液来吸收原料气中的CO,其反应是: ![]()
生产中必须除去原料气中CO的原因是 ___;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是___。
Ⅱ.氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,存在较多蓝、绿藻类的酸性水体中存在如有图所示的氮循环,请回答相关问题。
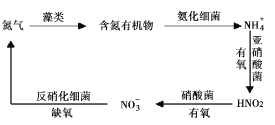
(3) NH4+硝化过程的方程式是2NH4++3O2 ![]() 2HNO3+2H2O+2H+,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____(填标号)。
2HNO3+2H2O+2H+,恒温时在亚硝酸菌的作用下发生该反应,能说明体系达到平衡状态的是____(填标号)。
A 溶液的pH不再改变
B NH4+的消耗速率和H+的生成速率相等
C 溶液中NH4+、NH3H2O、HNO3、NO2-的总物质的量保持不变
实验测得在其它条件一定时,NH4+硝化反应的速率随温度变化曲线如下图A所示,温度高于35℃时反应速率迅速下降的原因可能是 ___。
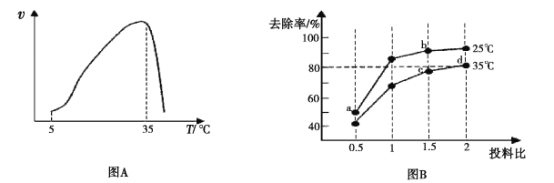
(4)亚硝酸盐含量过高对人和动植物都会造成直接或间接的危害,因此要对亚硝酸盐含量过高的废水进行处理。处理亚硝酸盐的方法之一是用次氯酸钠将亚硝酸盐氧化为硝酸盐,反应方程式是ClO-+ NO2-=NO3-+Cl-。在25℃和35℃下,分别向NO2-初始浓度为5×10-3 mol/L的溶液中按不同的投料比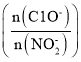 加人次氯酸钠固体(忽略溶液体积的变化),平衡时NO2-的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点ClO-的转化率由小到大的顺序是____,35℃时该反应的平衡常数K=____(保留三位有效数字)。
加人次氯酸钠固体(忽略溶液体积的变化),平衡时NO2-的去除率和温度、投料比的关系如上图B所示,a、b、c、d四点ClO-的转化率由小到大的顺序是____,35℃时该反应的平衡常数K=____(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有 关汉黄芩素的叙述正确的是
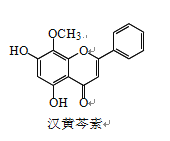
A. 汉黄芩素的分子式为 C16H13O5
B. 该物质遇 FeCl3 溶液显色
C. 1 mol 该物质与溴水反应,最多消耗 1 mol Br2
D. 与足量 H2 发生加成反应后,该分子中官能团的种类减少 1 种
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:

下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上
B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色
D. X→Y的反应为取代反应
查看答案和解析>>
科目: 来源: 题型:
【题目】增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
![]()
环己醇
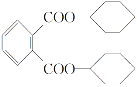
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物![]() 与
与![]() 可以通过配位键形成
可以通过配位键形成![]() 。
。
(1)在![]() 中,___________________原子提供孤电子对,___________________原子接受孤电子对。
中,___________________原子提供孤电子对,___________________原子接受孤电子对。
(2)写出![]() 的结构式,并用“→”标出配位键:____________________。
的结构式,并用“→”标出配位键:____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氧化锂(LiOH)是重要的初加T锂产品之一,可用于继续生产氟化锂、锰酸锂等,用天然锂辉石(主要成分LiAISi2O3,含有Fe (III)等杂质)生产LiOH的一种工艺流程如图所示:

已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO42-等离子,请回答相关问题。
(l)将LiAlSi2O6改写为氧化物的形式:____。
(2)高温烧结的目的是____。操作1是 __ 。
(3)净化过滤过程中溶液的pH不能过低也不能过高,原因是____。
(4)流程中的某种物质可循环利用,该物质的化学式是____。
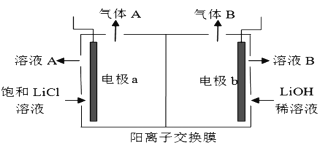
(5)工业生产中通过电解LiCI溶液的方法也可制得LiOH,其原理如图所示,电极a应连接电源的____(选填“正极”或“负极”),电极b发生的反应是 ___,阳离子交换膜的作用是___
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物的应用广泛。试回答下列问题:
(1)基态![]() 原子的价电子轨道表示式为__________,其第一电离能比
原子的价电子轨道表示式为__________,其第一电离能比![]() 的__________(填“大”或“小”)。
的__________(填“大”或“小”)。
(2)氨硼烷(![]() )被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的原子是__________,写出一种与氨硼烷互为等电子体的有机小分子:___________________(填化学式)。
(3)常温常压下硼酸(![]() )的晶体结构为层状,其二维平面结构如图所示。
)的晶体结构为层状,其二维平面结构如图所示。
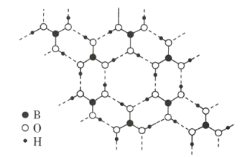
①B原子的杂化方式为__________。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大: _________________。
②路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸:______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质发生变化时,所克服的粒子间作用力属于同种类型的是( )
A.碘与干冰受热变为气体
B.硝酸铵与硝酸受热分解变为气体
C.氯化钠与氯化氢溶解在水中
D.晶体钠熔化与冰融化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com