
科目: 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目: 来源: 题型:
【题目】锂辉石是我国重要的锂资源之一,其主要成分为 Li2O、SiO2、Al2O3 以及含有少量 Na+、Fe2+、Fe3+、Ca2+、Mg2+等金属离子。工业上用锂辉石制备金属锂的工艺流程如下:
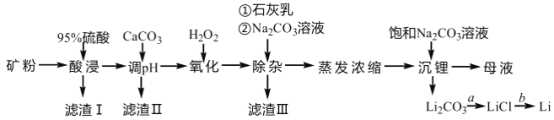
已知:①部分阳离子以氢氧化物形式沉淀时溶液的 pH 见下表:
沉淀物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Ca(OH)2 | Mg(OH)2 |
完全沉淀的pH | 5.2 | 9.6 | 3.2 | 13.1 | 10.9 |
②常温下,Ksp(Li2CO3)= 2.0×10-3。Li2CO3 在水中溶解度随着温度升高而减小。
③有水存在时,LiCl 受热可发生水解。
回答下列问题:
(1)为提高“酸浸”速率,上述流程中采取的措施有_____。
(2)滤渣 I 的主要成分是_____。滤渣 II 的主要成分是 Fe(OH)3、Al(OH)3。“氧化” 和“除杂”步骤主要除去的离子有_________。
(3) “沉锂”过程中发生反应的离子方程式是_____。用热水洗涤 Li2CO3 固体,而不用冷水洗涤,其原因是_____。
(4)设计简单的实验方案实现由过程 a 制取固体 LiCl:_____。
(5)工业上实现过程 b 常用的方法是_____。
(6)Li 可用于制备重要还原剂四氢铝锂(LiAlH4)。在有机合成中,还原剂的还原能力常用“有效氢”表示,其含义为 1克还原剂相当于多少克 H2 的还原能力。LiAlH4 的“ 有效氢”为_____(保留 2 位小数)。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.水电离的c(H+)=1×10-13mol/L 的溶液中:K+、Na+、![]() 、
、![]()
B.1.0mol/L的CH3COOH溶液:K+、Fe3+、![]() 、Cl-
、Cl-
C.在c(OH-):c(H+)=1×1012的溶液: ![]() 、Ca2+、Cl-、K+
、Ca2+、Cl-、K+
D.滴入酚酞试剂不变色的溶液:Na+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
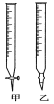
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将2molSO2和1molO2混合置于体积可变,压强恒定的密闭容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
2SO3(g);△H<0,当反应进行到时间t1点时达到平衡状态,测得混合气体总物质的量为2.1mol。试回答下列问题:
(1)反应进行到t1时,SO2的体积分数为__;
(2)若在t1时充入一定量的氩气(Ar),SO2的物质的量将__(填“增大”、“减小”或“不变”);
(3)若在t1时升温,重新达到平衡状态,新平衡混合物中气体的总物质的量_2.1mol(填“<”、“>”或“=”),简单说明原因:__。
(4)若t1达到平衡后,保持容器的体积不再变化。再加入0.2molSO2、0.1molO2和1.8molSO3,此时v逆_v正(填“<”、“>”或“=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
Ka1 | Ka2 | |
HA | 1×10-4 | |
H2B | 1×10-2 | 5×10-6 |
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
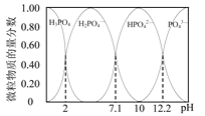
①当溶液pH由11到14时,所发生反应的离子方程式为:___。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,浓度均为0.1 mol/L体积均为V0的HA、HB溶液分别加水稀释至体积为 V的溶液。稀释过程中,pH与![]() 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是
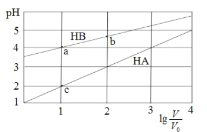
A.pH 随 ![]() 的变化始终满足直线关系
的变化始终满足直线关系
B.溶液中水的电离程度:a > b > c
C.该温度下,Ka(HB)≈ 10-6
D.分别向稀释前的HA、HB溶液中滴加 NaOH 溶液至 pH = 7 时,c(A-)= c(B-)
查看答案和解析>>
科目: 来源: 题型:
【题目】最近我国科学家对“液流电池”的研究取得新进展,一种新型的高比能量锌-碘溴液流电池工作原理如下图所示。下列有关叙述错误的是
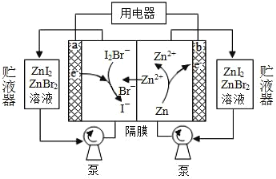
A.放电时,a 极电势高于 b 极
B.充电时,a 极电极反应为 I2Br-+2e-=2I-+Br-
C.图中贮液器可储存电解质溶液,提高电池的容量
D.导线中有 NA 个电子转移,就有 0.5 mol Zn2+通过隔膜
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验操作能产生对应实验现象的是
实验操作 | 实验现象 | |
A | 用玻璃棒蘸取氯化铵溶液,点在红色石蕊试纸上 | 试纸变蓝色 |
B | 向盛有 K2Cr2O7 溶液的试管中滴加浓硫酸,充分振荡 | 溶液由橙黄色逐渐变为黄色 |
C | 向 FeCl3 溶液中加入 KI 溶液,再加入苯,充分振荡,静置 | 溶液分层,上层呈紫色 |
D | 向蔗糖在硫酸催化下水解后的溶液中,加入新制 氢氧化铜悬浊液并加热 | 出现砖红色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com