
科目: 来源: 题型:
【题目】短周期主族元素X、Y、Z、W原子序数依次增加,X原子的半径小于Y原子,Y是地壳中含量最高的元素,Z原子的最外层只有1个电子,Y、W同主族。下列说法正确的是( )
A.原子半径:![]() B.Y与Z形成的化合物中只含离子键
B.Y与Z形成的化合物中只含离子键
C.W元素形成的最高价氧化物的水化物是强酸D.X与Z形成的化合物中X为![]() 价
价
查看答案和解析>>
科目: 来源: 题型:
【题目】M是应用广泛的有机高分子化合物,其中合成M的一种路线如下(部分反应条件略去):
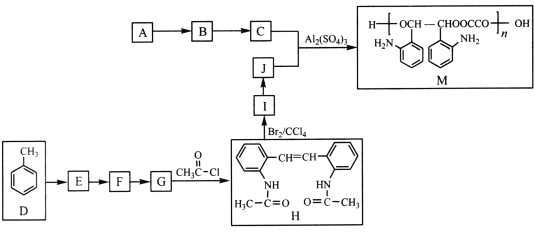
已知:①A的实验式为CH3O。
②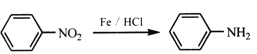 (-NH2容易被氧化)
(-NH2容易被氧化)
③![]()
④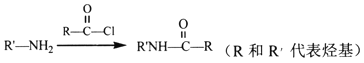
⑤![]()
回答下列问题:
(1)E的化学名称为_____________________________。
(2)H中官能团的名称为____________________________。
(3)D→E、I→J的转化过程中所用试剂和反应条件分别是_________、__________。
(4)C+J→M的化学方程式为_________________________________。
(5)同时满足下列条件的F的同分异构体有______种(不考虑立体异构)。
①含有的官能团与F相同;
②碳架结构与F完全相同;
③两个含氮官能团分别连在两个不同苯环上。
F的所有同分异构体在下列某种表征仪器中显示的信号(或数据)完全相同,该仪器为_______________(填序号)。
A.元素分析仪 B.红外光谱仪 C.质谱仪 D.核磁共振波谱仪
(6)参照上述合成路线和信息,以A和甲苯为有机原料(无机试剂任选),设计制备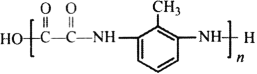 的合成路线。
的合成路线。
_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】关于水煤气变换反应CO(g)+H2O![]() CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
①H2O+*![]() H2O* ②H2O*+*
H2O* ②H2O*+*![]() OH*+H* ③OH*+*
OH*+H* ③OH*+*![]() O*+H* ④2H*+*
O*+H* ④2H*+*![]() H2+2*
H2+2*
⑤CO+*![]() CO* ⑥CO*+O*
CO* ⑥CO*+O*![]() CO2*+* ⑦CO2*
CO2*+* ⑦CO2*![]() CO2+*
CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
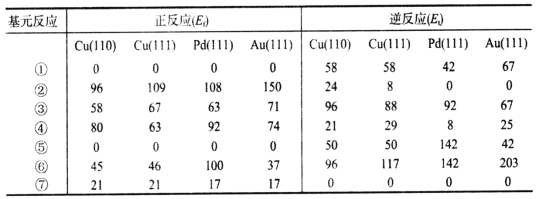
注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是___________(填序号)。
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=____kJ·mol-1。
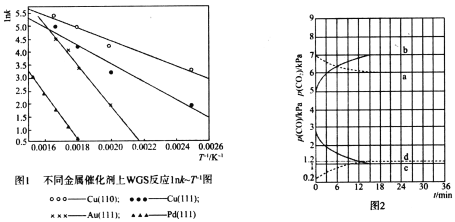
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图像。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是_______________。
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是_________、_________;T2、T3时WGS反应的KP分别为______、_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室模拟由“侯氏制碱法”制取Na2CO3,以下实验步骤能实现的是( )
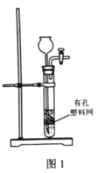

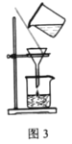
A.用图1装置由石灰石与稀盐酸制备CO2
B.用图2装置除去CO2中的HCl
C.用图3装置过滤所得的NaHCO3固体
D.用图4装置加热灼烧NaHCO3固体制Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿(主要成分为的Sb2S3,还含有As2S5、PbS、CuO和SiO2等)为原料制备金属锑,其一种工艺流程如下:
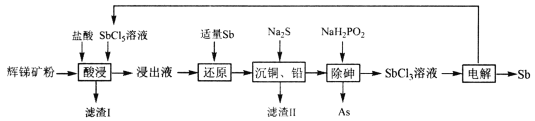
已知:I.浸出液主要含盐酸和SbC13,还含SbC15、CuC12、AsC13和PbC12等杂质。
II.25℃时,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)“酸浸”过程中SbC15和Sb2S3发生反应有一种单质和还原产物SbC13生成,则滤渣I的成分是_______________(填化学式)。
(2)写出“还原”反应的化学方程式_____________________。
(3)已知浸出液中c(Cu2+)=0.0lmol·L-1、c(Pb2+)=0.10mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_____________(填化学式);当CuS、PbS共沉时,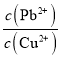 =_________。
=_________。
(4)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为__________________。
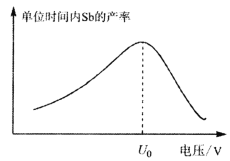
(5)在“电解”过程中,以惰性材料为电极,阳极的电极反应式为___________________,继而发生反应_________________(写出离子方程式)以实现溶液中Sb元素的循环使用。“电解”中单位时间内锑的产率与电压大小关系如图所示。当电压超过U0V时,单位时间内产率降低的原因可能是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙酰丙酮铜是金属有机化合物中一种重要的化合物,广泛应用于化工、石油、制药、电子、材料、机械等领域。实验室制备原理如下:
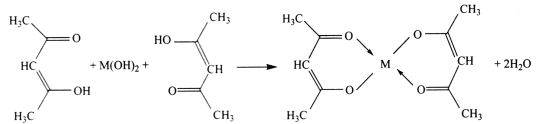
实验步骤:
(1)制取氢氧化铜(II)
分别称取4.000g(0.1mol)氢氧化钠、8.000g(0.05mol)无水硫酸铜于250mL、100mL烧杯中,加入适量的蒸馏水使其溶解,然后将硫酸铜溶液倒入氢氧化钠溶液中,摇匀,使反应完全,再将沉淀进行抽滤。
(2)制备乙酰丙酮铜(II)
称取0.1960g(2mmol)新制的氢氧化铜于100mL仪器a中,在氮气保护下加入少量的四氢呋喃,并进行搅拌,约五分钟之后,加入0.4000g(4mmol)乙酰丙酮,补充四氢呋喃约30mL,在50℃下加热回流约2h,然后冷却至室温,转移到锥形瓶中,用薄膜封口,放置4~5天,得到蓝色针状晶体。
已知:
I.氢氧化铜(II)分解温度为60℃。
II.四氢呋喃易挥发,沸点66℃,储存时应隔绝空气,否则易被氧化成过氧化物。
III.乙酰丙酮铜(II)是一种蓝色针状晶体,难溶于水,微溶于乙醇,易溶于苯、氯仿、四氯化碳。66.66kPa压力下,78℃升华。
回答下列问题:
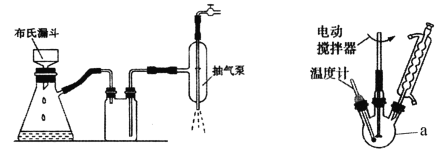
(1)制取氢氧化铜(II)时采用抽滤的方式进行,已知抽滤装置如图所示,抽滤与常规过滤相比其优点是____________________。
(2)制备乙酰丙酮铜(II)时采用氮气保护的目的________________,加入四氢呋喃的作用是__________________。
(3)加热回流简易装置如图(加热部分省略)所示,仪器a的名称是_______________,加热回流时采用球形冷凝管而不选用直形冷凝管的原因是________________。加热方式宜采用_______________。在50℃下加热回流的原因除防止四氢呋喃挥发外,还有可能的原因是_____________(用化学方程式表示)。
(4)若要纯化乙酰丙酮铜晶体,可以采用的实验方法是___________。若纯化后蓝色针状晶体的质量为0.3630g(乙酰丙酮铜的相对分子质量为262),则产率为________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】2020年“新冠”疫情在全球肆虐。下列说法不正确的是( )
A.酒精可以杀灭病毒是因为其能使构成病毒的蛋白质变性
B.研究表明,病毒可以通过气溶胶传播,气溶胶粒子的直径在![]() 之间
之间
C.口罩的核心材料熔喷布聚丙烯是一种有机高分子化合物
D.“84”消毒液的主要成分是HClO
查看答案和解析>>
科目: 来源: 题型:
【题目】一氧化氮-空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电环保三位一体的结合。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和粗铜的精炼原理。
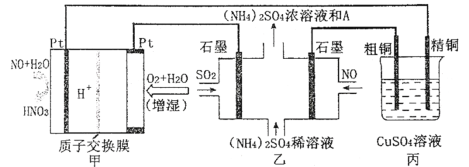
(1)燃料电池放电过程中负极的电极反应式____。
(2)乙装置中物质A是____(填化学式),理由是___;电解过程中阳极附近pH___(填“增大”“减小”或“不变”),阴极的电极反应式是____。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO4溶液的浓度将__(填“增大”、“减小”或“不变”)。
(4)若在标准状况下,甲装置有22.4 L O2参加反应,则乙装置中转化SO2和NO的物质的量共有____mol;丙装置中阴极析出铜的质量为___g。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。
(1)硫酸铜溶液可以加快氢气生成速率的原因是____。
(2)25℃,该同学设计三个实验探究影响锌粉(足量)与稀硫酸反应速率的因素,有关数据如下表所示:
实验序号 | 体积/mL | ||
1.0mol·L-1硫酸溶液 | 饱和CuSO4溶液 | 水 | |
I | 30.0 | 1.0 | 9.0 |
II | 20.0 | 1.0 | Vx |
III | 30.0 | 3.0 | 7.0 |
①本实验待测数据可以是____。
②利用实验I和实验I来探究硫酸浓度对锌粉与稀硫酸反应速率的影响,Vx=__,理由是__。
③实验I和实验III的目的是__。
(3)用排水集气法收集实验I反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 60 | 140 | 252 | 420 | 510 | 540 |
①反应速率最大时间段是__min(填“0~1”、“1~2”、“2~3”、“3~4”、“4~5”或“5~6”下同),原因是____。
②反应速率最小时段是__min,原因是___。
③第2~3min时间段以稀硫酸的浓度表示的该反应速率(设溶液体积不变)是v(H2SO4)=___。
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,在稀硫酸中分别加入等体积的下列溶液,可行的是____(填字母)。
A.KNO3溶液 B.蒸馏水 C.Na2SO4溶液 D.Na2CO3溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的![]() 可转化为
可转化为![]() ,该反应分两步反应:
,该反应分两步反应:
I:2![]() +(aq)+3O2(g)=2
+(aq)+3O2(g)=2![]() (aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
(aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
II:2![]() (aq)+O2(g)=2
(aq)+O2(g)=2![]() (aq) △H=-146 kJ·mol-1
(aq) △H=-146 kJ·mol-1
则低浓度氨氮废水中的![]() (aq)氧化生成
(aq)氧化生成![]() (aq)的热化学方程式为_____。
(aq)的热化学方程式为_____。
(2)在容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____(填“正反应”或“逆反应”)方向移动,判断理由是____。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是___(填字母)。
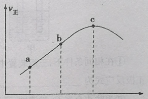
A.逆反应速率:a点小于点c
B.反应在c点达到平衡状态
C.反应物浓度:a点小于b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com