
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| △ |
查看答案和解析>>
科目: 来源: 题型:

| NaOH |
| 水溶液△ |
| 自动脱水 |


查看答案和解析>>
科目: 来源: 题型:





查看答案和解析>>
科目: 来源: 题型:阅读理解
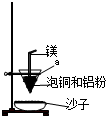 工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.
工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.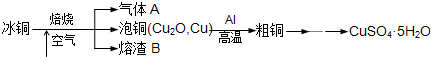
| ||
| ||
| 滴定剂 |
| 5bc |
| 4a |
| 5bc |
| 4a |
查看答案和解析>>
科目: 来源: 题型:阅读理解
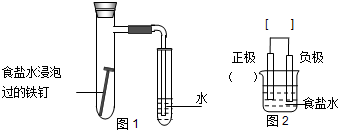
查看答案和解析>>
科目: 来源: 题型:
 Cl2合成有机物时会产生副产物HCl.4HCl+O2
Cl2合成有机物时会产生副产物HCl.4HCl+O2| CuO/CuCl2 |
| 400℃ |
| c2(Cl2)×c2(H2O) |
| c4(HCl)×c(O2) |
| c2(Cl2)×c2(H2O) |
| c4(HCl)×c(O2) |
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com