
科目: 来源: 题型:
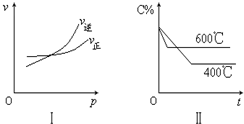 图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间.图Ⅰ为温度一定时压强与反应速率的关系曲线;图Ⅱ为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )
图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间.图Ⅰ为温度一定时压强与反应速率的关系曲线;图Ⅱ为压强一定时,在不同时间C%与温度的关系曲线.同时符合以下两个图象的反应是( )查看答案和解析>>
科目: 来源: 题型:
 奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )查看答案和解析>>
科目: 来源: 题型:
 ,2
,2 ,2
,2查看答案和解析>>
科目: 来源: 题型:
| ||
查看答案和解析>>
科目: 来源: 题型:
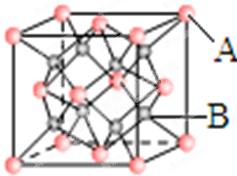 一种离子晶体的晶胞如图其中阳离子A以
一种离子晶体的晶胞如图其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示.
表示.| 2 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 2 | 3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com